Tensioactif - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un tensioactif ou agent de surface est un composé qui modifie la tension superficielle entre deux surfaces. Les composés tensioactifs sont des molécules amphiphiles, c'est-à-dire qu'elles présentent deux parties de polarité différente, l'une lipophile (qui retient les matières grasses) et apolaire, l'autre hydrophile (miscible dans l'eau) et polaire.
Il permet ainsi de solubiliser deux phases non miscibles, en interagissant avec l'une apolaire (c'est à dire lipophile donc hydrophobe), par sa partie hydrophobe; tandis qu'avec l'autre phase qui est polaire, il interagira par sa partie hydrophile.
Au Canada notamment, on parle aussi de surfactif, transposition du mot anglais surfactant qui est la compression de « surface active agent » (agent de surface actif).
Propriétés des tensioactifs
Les propriétés des tensioactifs sont dues à leur structure amphiphile. Cette structure leur confère une affinité particulière pour les interfaces de type huile/eau et eau/huile et donc, par là même, leur donne la capacité d'abaisser l'énergie libre de ces interfaces. Ce phénomène est à la base de la stabilisation de systèmes dispersés.
En tant qu'agents émulsifiants ou stabilisants, on peut détailler leur action en trois points:
- ils facilitent la formation de gouttes en diminuant cette tension de surface, car l'énergie nécessaire à leur formation est directement proportionnelle à la tension de surface
- ils stabilisent les gouttes formées en diminuant le gradient de pression au niveau de l'interface
- ils stabilisent les gouttes vis à vis de l'agrégation, en apportant des répulsions électrostatiques ou/et stériques entre les gouttes
Un agent tensio-actif est un corps qui, même utilisé en faible quantité, modifie de façon importante la tension superficielle, en particulier celle de l'eau. Ainsi à l'exception des sels minéraux ou des bases (sauf l'ammoniac), la majorité des agents tensio-actifs abaissent la tension superficielle de l'eau. Cependant pour connaitre leur caractère hydrophile ou hydrophobe majoritaire, on peut raisonner sur la valeur de leur HLB (balance hydrophile/hydrophobe).
D'après la méthode de Davies,
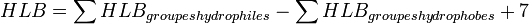
Il existe des tables de HLB pour différents groupes classiques. Si on obtient une HLB comprise entre 1 et 6, on a typiquement affaire à un tensioactif hydrophobe qui donnera des émulsions inverses. Pour une HLB supérieure à 10, il aura clairement un caractère hydrophile et donnera des émulsions directes.
Types de tensioactifs
On distingue quatre types de composés tensioactifs, regroupés selon la nature de la partie hydrophile :
- tensioactifs anioniques : leur partie hydrophile est chargée négativement.
- tensioactifs cationiques : leur partie hydrophile est chargée positivement.
- tensioactifs zwitterioniques ou amphotères : leur partie hydrophile comporte une charge positive et une charge négative, la charge globale est nulle.
- tensioactifs non ioniques : la molécule ne comporte aucune charge nette.
Les tensioactifs anioniques
Ils libèrent une charge négative (anion) en solution aqueuse. Ils ont une balance Hydrophile/Lipophile (HLB) relativement élevée (8 à 18) car ils ont une tendance hydrophile plus marquée. Ils orientent l'émulsion dans le sens H/E, Huile/Eau (si HLB>18 alors détergent).
Ils ne sont pas compatibles avec les Tensioactifs cationiques.
Les tensioactifs cationiques
Ils libèrent une charge positive (cation) en solution aqueuse. Ils ont les propriétés bactériostatiques et émulsionnantes. Ils ont une affinité avec la kératine de la peau ou des cheveux, car chargée négativement ; ils se combinent avec elle pour former un film lisse.
On les utilise dans les après-shampoing, les antipelliculaires, certaines teintures, les déodorants. C'est le produit actif des assouplissants textiles en feuilles et liquides (Bounce, Fleecy, etc.). Ils s'adsorbent à la surface des tissus, les chargeant négativement, réduisant les forces électrostatiques présentes, et par là l'électricité statique présente. Ils rendent les tissus plus souples.
Ils sont irritants pour la muqueuse oculaire.
Ils ne sont pas compatibles avec les tensioactifs anioniques.
Les tensioactifs zwitterioniques ou amphotères
Suivant le pH du milieu où ils se trouvent, ils libèrent un ion positif et un ion négatif.
- En pH alcalin, ils se comportent comme des anioniques,
- en pH acide, ils se comportent comme des cationiques.
Les tensioactifs amphotères ont une HLB élevée ; et sont donc utilisés comme détergents.
Moins agressifs que les anioniques, ils sont recommandés pour les peaux fragiles.
Ils sont compatibles avec les autres Tensioactifs.
Les tensioactifs non ioniques
Leur molécule ne comporte aucune charge nette. On dit qu'ils comptent parmi les meilleurs détergents.
Un agent tensioactif non ionique connu et très fréquemment utilisé en chimie et en biologie est le Tween (Tween 20, 60, 80...) ou ester de sorbitan, mais on utilise aussi des esters de saccharose. Ces membres de la famille des esters de sucre sont constitués d'un groupement osidique hydrophile et d'une chaîne grasse hydrophobe. Les esters de sucre ont plusieurs avantages en tant que tensioactifs :
- matières premières peu coûteuses et renouvelables
- biodégradabilité complète en aérobiose et en anaérobiose
- molécules ne présentant ni toxicité ni caractère irritant
- absence de goût et d'odeur
- molécule non ionique
- large gamme de structures disponibles
Commons:

















































