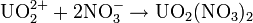Uranium - Définition
La liste des auteurs de cet article est disponible ici.
Propriétés
Propriétés radiologiques
Produit fissible naturel
L'uranium 235 est le seul nucléide naturel qui soit fissile, ou fissible, autrement dit il peut, par capture de neutron, se scinder en deux noyaux fils avec émission de neutrons (fission nucléaire). Par suite, l'uranium enrichi en cet isotope est aujourd'hui utilisé comme combustible nucléaire dans les réacteurs nucléaires (voir cycle du combustible nucléaire) ou encore dans les armes nucléaires, que ce soient les bombes atomiques, ou comme amorce dans les bombes H.
Au contraire de l'uranium 235, l'uranium 238, lorsqu'il capture un neutron, ne fissionne pas (sauf neutrons rapides). Il devient de l'uranium 239 instable qui, par désintégration β − , va se transformer en neptunium 239. Or ce dernier est lui aussi radioactif β − , et va alors donner naissance à un nouveau noyau, le plutonium 239. Ce radioisotope est fissile, comme l'uranium 235. L'uranium 238 est un isotope fertile, qui peut produire des produits fissiles.
L'uranium 234 n'est, lui, ni fissile, ni fertile, et provient de la décomposition radioactive de l'uranium 238 comme indiqué dans la précédente section.
La fission d'un atome d'uranium 235 libère de l'ordre de 200 MeV (la valeur exacte dépendant des produits de fission). De même, la fission d'un atome de plutonium 239 libère de l'ordre de 210 MeV. Ces valeurs sont à comparer avec celles de la combustion de carburants fossiles, qui libèrent de l'ordre de 5 eV par molécule de CO2 produit: l'ordre de grandeur des énergies libérées par les combustibles nucléaires est un million de fois plus importante que celle des énergies fossiles chimiques.
Le potentiel d'énergie de l'uranium n'est exploité que très partiellement dans les réacteurs actuels, mais la différence reste nette : 1 kg d'uranium naturel permet la production d'environ 500 000 MJ dans un réacteur conventionnel, à comparer avec les 39 MJ obtenus par 1 kg de gaz naturel, 45 MJ pour 1 kg de pétrole, et 20 à 30 MJ pour le charbon.
Les isotopes de l'uranium naturel
L'uranium a 17 isotopes, tous radioactifs, dont 3 seulement sont présents à l'état naturel : 238U ; 235U et 234U. On trouve dans une tonne d'uranium naturel pur 7,1 kg d'uranium 235 et 54 g d'uranium 234, le reste étant de l'uranium 238.
Les isotopes 238 et 235 ont beaucoup d'applications, militaires notamment, mais aussi civiles, comme, par exemple, la datation de l'âge de la Terre à partir de la datation radiométrique à l'uranium-plomb ou à l'uranium-thorium.
Quelles que soient les teneurs en uranium des milieux, les proportions entre les deux principaux isotopes formant l'uranium naturel sont pratiquement les mêmes : 238U : 99,28 % ; 235U : 0,71 %.
- La proportion d'235U décroit à l'échelle des temps géologiques. Leur rapport de formation dans une supernova est de un à 1,65, c'était la proportion de l'uranium présent sur terre il y a 6,5 milliards d'années, ce qui correspond sensiblement à l'âge de leur formation (voir formation et évolution du système solaire). Il y a deux milliards d'années, lors de la période de fonctionnement du réacteur nucléaire naturel d'Oklo, la proportion d'235U était encore de près de 4 %, ce qui a permis à ce gisement d'atteindre la criticité.
Le troisième isotope 234U appartient à la chaîne de désintégration de l'238U. L'isotope 234 est toujours présent sur Terre, à l'état de traces, bien qu'il ait une demi-vie de seulement 245 500 ans ; car il est constamment généré par désintégration radioactive de l'isotope 238 (après 3 étapes : une transition α donnant 234Th, puis deux transitions β- donnant 234Pa, puis 234U). Quand il est à l'équilibre séculaire, la proportion entre 238U et 234U est égale au rapport des demi-vies, soit 0,0056 %.
Cependant, les rapports isotopique peuvent varier légèrement d'un gisement à l'autre, entre 0,005 % et 0,006 % pour l'234U, du fait d'une légère différence de comportement dans le changement U6+↔ U4+. Le rapport isotopique 234U/238U peut être perturbé par différents processus environnementaux, tandis que le rapport 235U/238U reste assez largement constant.
L'industrie nucléaire produit deux autres isotopes artificiels de l'uranium, relativement stables à échelle humaine :
- L'isotope 236 est produit en réacteur par irradiation de l'isotope 235, qui dans près de 18 % des cas ne fissionne pas mais absorbe un neutron. Il tend à s'accumuler dans l'uranium de recyclage, dont il augmente fortement la radioactivité, et dont (étant neutrophage) il diminue le potentiel énergétique. Bien qu'ayant une demi-vie de {{unité|23|millions} d'années, presque du centuple de celle de l'isotope 234, cet isotope a disparu depuis longtemps dans la nature, et se trouve à présent majoritairement sous forme de thorium 232 (et les éléments de sa chaîne de désintégration).
- L'isotope 233 est un élément fissile produit en réacteur par irradiation du thorium. Il est à la base du cycle du thorium. Sa demi-vie de 159000 est largement supérieure à celle du plutonium.
Activité massique
L'uranium pur est radioactif, son activité massique dépendant à la fois de son enrichissement, et de la fraîcheur de sa purification chimique.
Si l'on considère les isotopes purs de l'uranium, 238U a une activité massique de 12,4 Bq/mg, 235U de 80 Bq/mg, et 234U de 230 Bq/µg, soit 230 000 Bq/mg — quatre ordres de grandeur au-dessus des précédents.
- L'uranium naturel, quand il est chimiquement purifié (essentiellement composé de 235U et de 238U en équilibre avec son descendant 234U), a une activité spécifique de l'ordre de 25 Bq/mg. En amont, à poids égal d'uranium, la radioactivité d'un minerai, où il est en équilibre avec tous les éléments radioactifs de sa chaîne de désintégration, est naturellement 3 (si le Radon peut s'échapper) à 7 fois plus importante.
- L'uranium enrichi est plus actif, partiellement du fait de l'activité plus importante de 235U (6,33 fois plus radioactif que l'238U), mais surtout à cause de la concentration différentielle en 234U (10 000 fois plus radioactif que 238U), toujours présent à l'état de traces dans la chaine de désintégration de l'isotope 238. Elle atteint typiquement 2 500 Bq/mg pour un enrichissement de 90 % (uranium dit de qualité militaire). Pour les enrichissements de l'ordre de 3 %, destinés aux centrales nucléaires, l'activité spécifique est de l'ordre de 60 Bq/mg.
- Inversement, l'uranium appauvri est presque entièrement débarrassé non seulement de sa fraction de l'isotope 235, mais également de son descendant l'isotope 234. Immédiatement après l'enrichissement, son activité massique tend à se rapprocher de celle de 238U pur, c'est-à-dire de l'ordre de 12,5 Bq/mg (en pratique, un peu plus du fait de la présence résiduelle d'235U). Cependant, l'équilibre entre 238U et ses deux premiers descendants (le thorium 234 de période 24 jours, et le protactinium 234) est atteint rapidement, en 2 mois. La radioactivité spécifique à l'équilibre (avec ses deux premiers descendants) étant déjà de 41,5 Bq/mg.
Propriétés chimiques
De symbole U, l'uranium est le dernier élément naturel du tableau périodique de Mendeleïev. Chaque atome d'uranium possède 92 protons et entre 125 et 150 neutrons.
À l'état pur, l'uranium solide est un métal radioactif gris à blanc (voire argenté), qui rappelle la couleur du nickel. Il est dur et très dense. De plus, l'uranium est l'atome le plus lourd (qui contient le plus de nucléons) présent naturellement sur la Terre.
En raison de son affinité pour l'oxygène, l'uranium s'enflamme spontanément dans l'air à température élevée, voire à température ambiante lorsqu'il se trouve sous forme de microparticules. Il est pyrophorique.
Ainsi dans la nature, l'élément uranium se retrouve toujours en combinaison avec d’autres éléments, tels l'oxygène, l'azote, le soufre, le carbone ; en oxydes, nitrates, sulfates ou carbonates. On le trouve, par exemple, en combinaison avec l'oxygène dans l'uranite et la pechblende, deux des principaux minerais d'uranium, constitués d'oxyde uraneux (UO2).
Enfin, les ions uranyle (
Dérivé organo-uranien
Comme la plupart des métaux, l'uranium a une chimie organo-métallique et de nombreux complexes organo-métalliques tel l'uranocène sont connus.