Acétate de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acétate de sodium | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
| Synonymes | Acétate de soude Sel sodique de l'acide acétique |
| No CAS | (anhydre) (trihydrate) |
| No EINECS | |
| No E | E262(i) |
| FEMA | |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline blanche, hygroscopique. |
| Propriétés chimiques | |
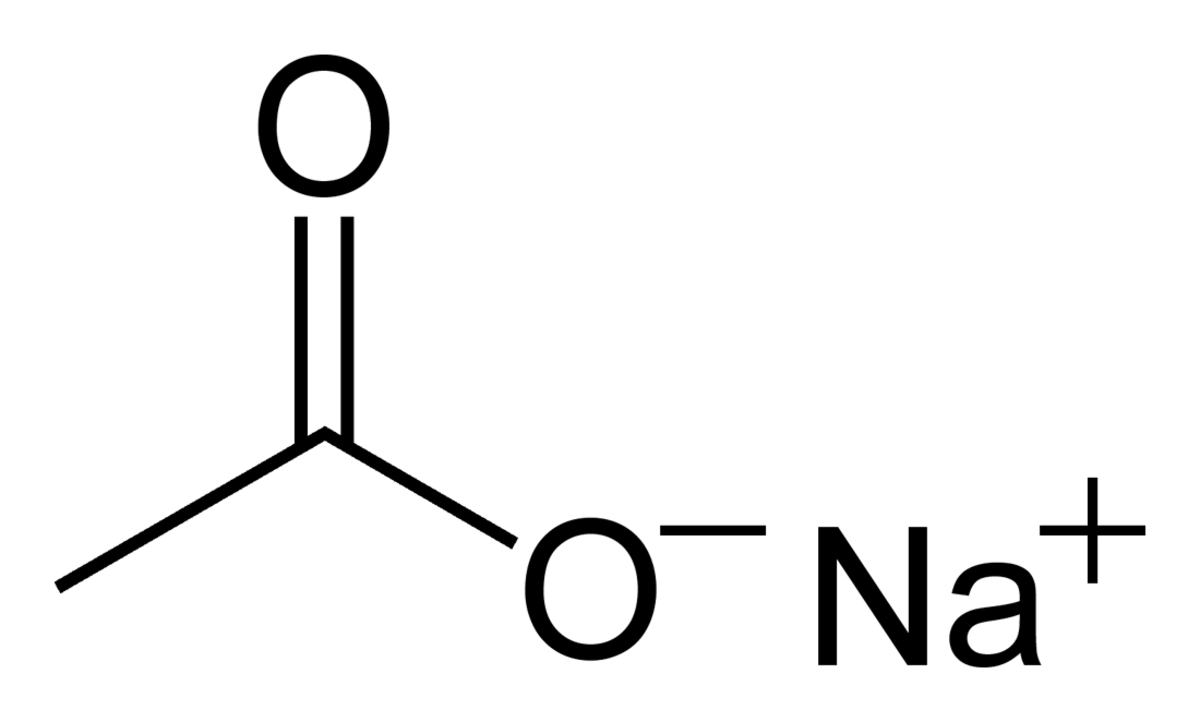
| Formule brute | C2H3NaO2 |
| Masse molaire | 82,0338 ± 0,0024 g·mol-1 136,08 g/mol (trihydrate) |
| Propriétés physiques | |
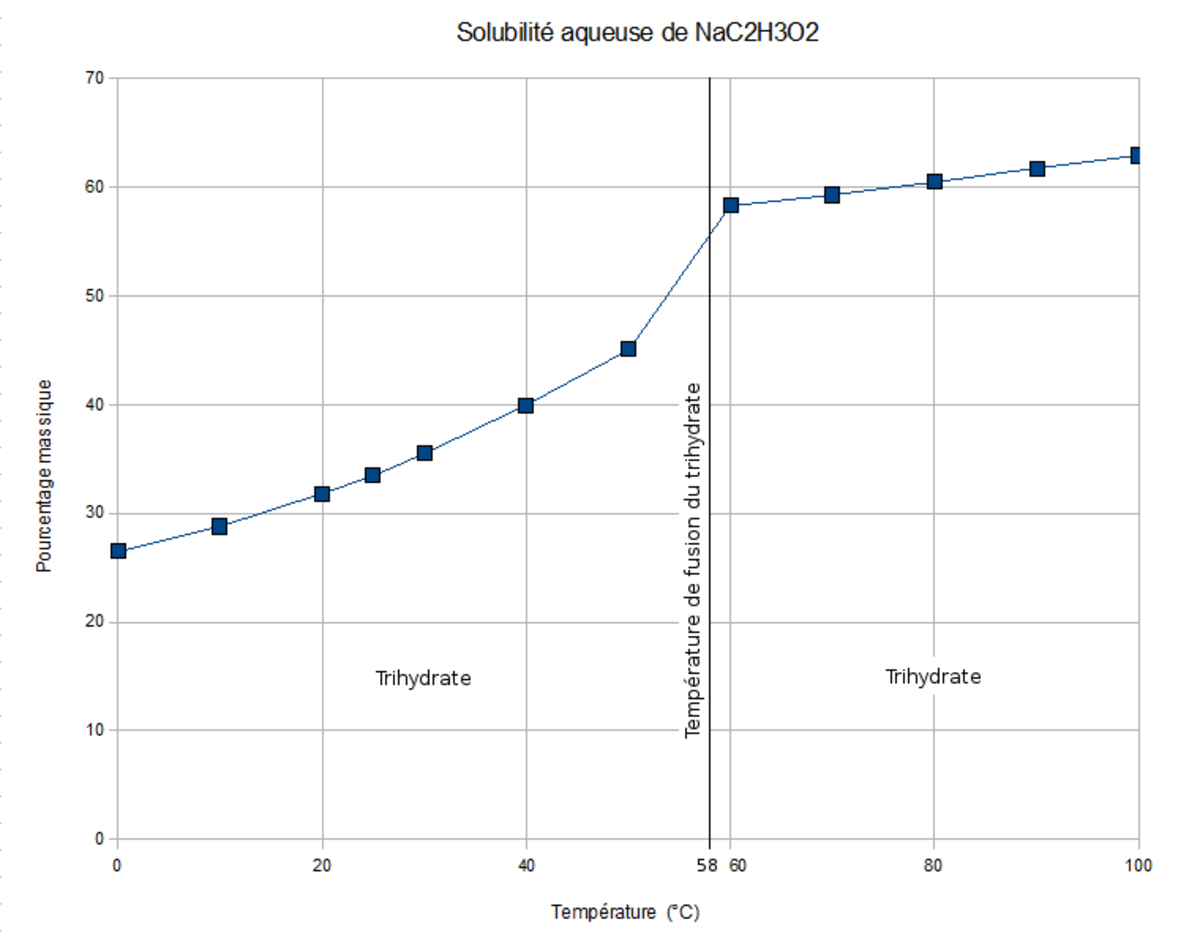
| T° fusion | 58 °C (libération de l'eau du trihydrate) |
| T° ébullition | Décomposition à 324 °C en Na2O |
| Solubilité | 365 g·l-1 (eau, 20 °C) |
| Masse volumique | 1,52 g·cm-3 (anhydre, 20 °C), 1,42 g·cm-3 (trihydrate, 20 °C), |
| T° d’auto-inflammation | 607 °C |
| Point d’éclair | > 250 °C (anhydre, coupelle fermée) |
| Précautions | |
| | |
| Phrases S : 24/25, | |
| | |
| Acétate de sodium : Produit non contrôlé Acétate de sodium trihydraté : Produit non contrôlé | |
| | |
L'acétate de sodium est un composé de formule CH3COONa. Il est dissoluble dans l'eau et constitue une bonne source d'ions acétate. Sa solution aqueuse est basique en raison de la réaction : CH3COO-+H2O → CH3COOH+HO-. Ce composé est utilisé pour faire des expériences simples de solutions aqueuses sursaturées.
Synthèse
L'acétate de sodium apparaît comme sous-produit de la saponification des acétates d'alkyle par la soude. Il peut également être extrait en distillant le produit de réaction d'une solution d'acide acétique (ou éthanoïque) de formule CH3-COOH et de soude NaOH.
Synthèse "maison"
Une production "maison" avec des produits du quotidien est également à noter.
Diluer petit à petit 80g de bicarbonate de soude (facilement trouvable en grandes surfaces) avec 650ml de vinaigre blanc à 10% (idem) dans un récipient en verre propre, et touiller avec une cuillère métallique jusqu'à dissolution complète. Ceci fait, continuer de touiller encore une à deux minutes. Placer ensuite dans une casserole, sur feux moyen, avec beaucoup d'aération (attention aux vapeurs). Vers la fin de l'évaporation, baisser à feux très doux afin d'éviter de bruler la matière se trouvant au fond de la casserole alors. Après évaporation complète, se trouve au fond de la casserole une poudre blanche, c'est notre acétate de sodium. (Source : WikiDébrouillard)
Utilisations
On retrouve dans le commerce des pochettes vendues comme sources de chaleur portatives (chaufferettes). Ces pochettes contiennent une solution aqueuse saturée en acétate de sodium en sursaturation, la température de dissolution étant à 54 °C pour une solution à 20%, ce qui est bien au-dessus de la température ambiante. Une variation de pression (par trituration) ne suffit pas, en règle générale, à provoquer la précipitation. En tordant une plaquette métallique à l'intérieur du liquide, on libère des germes d'acétate solidifié qui déclenchent la cristallisation et la solution devient solide. Cette transformation est exothermique, ce qui signifie qu'elle s'accompagne d'un dégagement de chaleur, suffisant pour procurer un réconfort à l'utilisateur. On dissout à nouveau le sel en plaçant la pochette dans de l'eau très chaude ; même en refroidissant, l'acétate de sodium demeure en solution.
L'acide acétique est un acide naturel dont le sel est un agent conservateur (numéro E262) présent dans les fruits et les produits fermentés.