Acide glyoxylique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide glyoxylique | |||
|---|---|---|---|

| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | acide oxoéthanoïque acide oxadéhydique | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule brute | C2H2O3 | ||
| Masse molaire | 74,0355 ± 0,0026 g·mol-1 | ||
| pKa | 3.3 à 25 °C | ||
| Propriétés physiques | |||
| T° fusion | 98 °C | ||
| T° ébullition | 100 °C | ||
| Point d’éclair | 110 °C | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 34, | |||
| Phrases S : 26, 36/37/39, 45, | |||
| | |||
| |||
| Écotoxicologie | |||
| DL | 2,5 g·kg-1 (rat, oral) | ||
| | |||
L'acide glyoxylique ou acide oxoacétique est un acide organique. Avec l'acide acétique, l'acide glycolique et l'acide oxalique, l'acide glyoxylique est l'un des acides carboxyliques en C2. C'est un solide incolore naturellement présent et il est utile industriellement.
Propriétés physico-chimiques
L'acide glyoxylique est généralement décrit avec la formule semi-développée OCHCO2H, c'est-à-dire associant des fonctions acide carboxylique et aldéhyde. En fait, l'aldéhyde n'est pas observé ni en solution, ni à l'état solide. En général, les aldéhydes connectés à des substituants électroattracteurs existent principalement sous forme de leur hydrate. Ainsi, la formule de l'acide glyoxylique est en réalité (HO)2CHCO2H, décrit comme le "monohydrate". Ce diol géminal est en équilibre avec l'hémiacétal dimérique en solution :
- 2 (HO)2CHCO2H
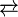
L'acide glyoxylique est environ dix fois plus acide que l'acide acétique avec un Ka de 4.7 x 10−4 :
- (HO)2CHCO2H
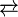
En présence de bases, l'acide glyoxylique dismute:
- 2 OCHCO2H + H2O → HOCH2CO2H + HO2CCO2H
Même si la forme aldéhyde est très minoritaire dans ses solutions, l'acide glyoxylique se comporte comme un aldéhyde dans ses réactions. Par exemple, il donne des hétérocycles par condensation avec l'urée ou le 1,2-diaminobenzène (en).
Production et synthèse
Ce composé est formé par oxydation organique d'éthanedial avec de l'acide nitrique à une température comprise entre 40 °C et 90 °C, le principal sous-produit étant l'acide oxalique qui est séparé par cristallisation. Les résidus d'acide sont éliminés par une résine échangeuse d'anions. L'ozonolyse de l'acide maléique est aussi efficace.
La base conjuguée de l'acide glyoxylique est l'anion glyoxylate (oxoacétate, oxoéthanoate) et c'est sous cette forme que ce composé existe en solution à pH neutre (pH=7). Les glyoxylates sont un intermédiaire dans le cycle du glyoxylate qui permet aux organismes comme les bactéries, les Fungi et les plantes de convertir les acides gras en carbohydrates.Le glyoxylate est aussi le sous-produit du processus d'amidation dans la biosynthèse de plusieurs peptides amidés.
Dérivés phénoliques
Sa condensation avec les phénols est versatile. Le produit intermédiaire est l'acide 4-hydroxymandélique ou l'un de ses dérivés. Ces espèces réagissent avec l'ammoniac pour donner l'hydroxyphénylglycine, un précurseur de l'antibiotique amoxicilline. La réduction de l'acide 4-hydroxy-mandélique donne l'acide 4-hydroxyphénylacétique, un précurseur du médicament aténolol.
Les condensations avec le guaiacol en lieu et place de phénols fournissent une voie de synthèse pour la vanilline via une formylation.


















































