Chiralité (chimie) - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Le concept de la chiralité existe également dans d'autres domaines.
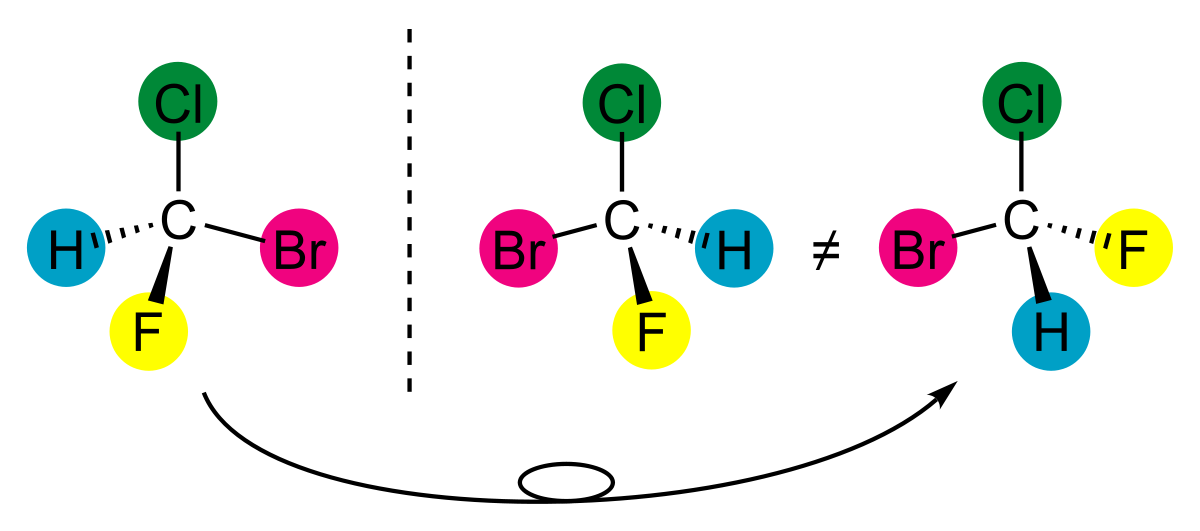
En chimie, un composé chimique est chiral, du grec « χειρ » (la main), s'il n'est pas superposable à son image dans un miroir. Si une molécule est chirale, elle possède deux formes énantiomères : une lévogyre (« qui tourne à gauche », en latin laevus : gauche) et une dextrogyre (« qui tourne à droite », en latin dextro : droite) qui font tourner un rayonnement polarisé de manière opposée.
Molécules chirales
La chiralité peut être comparée à un simple problème de chaussures. Tous les enfants ont déjà été confrontés à un problème de chiralité en mettant le pied droit dans la chaussure gauche et inversement. Une chaussure est un objet chiral car elle n'est pas superposable à son image dans un miroir, tout comme les mains. Les molécules peuvent également être des objets chiraux.
Molécules contenant un « carbone asymétrique »
La distribution d'atomes différents dans l'espace, par exemple autour d'un point, peut conduire à des situations non superposables dans un miroir, donc des objets différents. En général, le carbone tétravalent peut accepter 4 substituants différents sur chacune de ses 4 liaisons, ce qui donne lieu à deux formes non-superposables dans un miroir, des énantiomères dénommés R et S:
Un tel atome de carbone est habituellement appelé « carbone asymétrique ». La présence d'un tel atome de carbone dans une molécule la rend chirale. Il existe toutefois des exceptions à cette règle, pour les molécules contenant plus d'un carbone asymétrique ( composés méso, voir plus bas). Par exemple, les acides aminés (sauf la glycine) sont des molécules chirales : un acide aminé et son image dans un miroir ne sont pas superposables car la molécule contient un atome de carbone asymétrique (lié à 4 atomes ou groupements d'atomes différents). Voici un exemple : l'acide aminé Alanine (deux énantiomères nommés et ce qui correspond aux configurations absolues - définies par l'UIPAC- R et S).
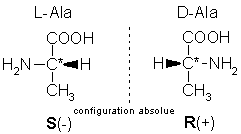
Il est à noter que le concept d'atome de carbone asymétrique, s'il a été utilisé du point de vue historique et est encore employé fréquemment dans l'enseignement de la chimie, ne correspond pas aux recommandations actuelles de l'IUPAC. En effet, le terme correct est chiralité centrale autour d'un atome de carbone. Le carbone portant 4 substituant non identiques est un centre de chiralité.
Autres molécules chirales
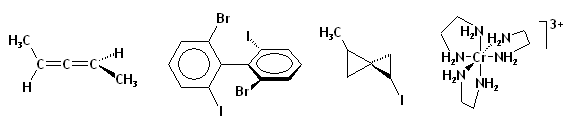
La chiralité n'est pas limitée au carbone ou aux autres atomes tétravalents :
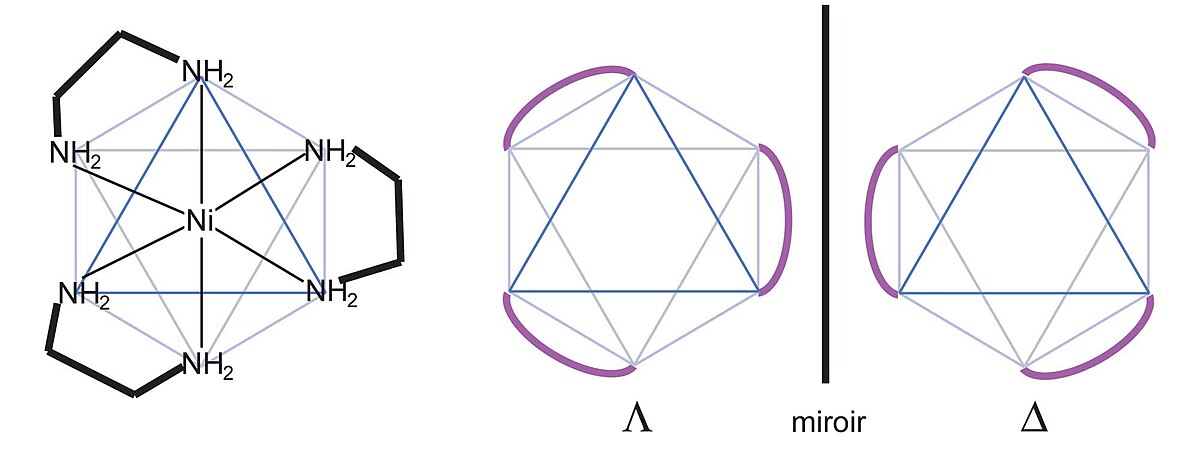
- complexes métalliques octaédriques et métallocènes peuvent être chiraux. Le cas le plus fréquent est celui des complexes comportant trois ligands bidentes qui donne lieu à un environnement chiral.
- molécules possédant un axe de chiralité comme les allènes, les biphényles et les composés spiro.
- molécules possédant un plan de chiralité comme le Z-cyclooctène
- molécules présentant une hélicité comme les hélicènes et de nombreux polymères d'origine biologique comme les protéines et les acides nucléiques.
Formellement, c'est la symétrie de la molécule qui détermine si elle est chirale ou non (elle est alors appelée achirale). Dans la pratique, une molécule est chirale si et seulement si elle est dépourvue de tout axe de rotation impropre d'ordre n (n entier strictement positif), noté Sn. Il s'agit de la rotation de la molécule de nπ autour de l'axe, suivie d'une réflexion par rapport à un plan perpendiculaire à cet axe. Un axe de rotation impropre d'ordre 1 (S1) est un plan de symétrie (noté σ) et un axe de rotation impropre d'ordre 2 (S2) est un centre de symétrie (noté i).
Les énantiomères de complexes métalliques octaédriques possédant 3 ligands bidentes sont dénommés Δ (delta, droit) et Λ (lambda, gauche) et déterminés comme suit :
On dispose l'octèdre sur une face qui regroupe un bout de chaque ligand (on le regarde selon un axe de symétrie d'ordre 3 , la symétrie du complexe est D3), les sommets de l'octaèdre se répartissent sur deux plans. Si un sommet du plan supérieur est lié par un ligand au sommet à sa droite sur le plan inférieur, le complexe est dit droit ou Δ. En revanche, si le sommet inférieur est à sa gauche, le complexe est gauche ou Λ.
Les énantiomères d'allènes, biphényles et des composés spiro sont déterminés par des règles précises de l'IUPAC et sont dénommés aR et aS (a=axe).
Les énantiomères de molécules possédant un plan de chiralité comme le Z-cyclooctène sont notés pR et pS (p=plan).
Pour les molécules comportant un enroulement hélicoïdal, les énantiomères correspondent aux deux sens d'enroulement de l'hélice et sont nommés P (plus) pour l'hélice de pas droit et M (moins) pour l'hélice de pas gauche.