Chlorure de cuivre(I) - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure de cuivre(I) | |||
|---|---|---|---|

| |||
| Général | |||
| Synonymes | Chlorure cuivreux | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| Apparence | poudre blanche d'aspect verdâtre dû à la présence de traces de chlorure cuivrique | ||
| Propriétés chimiques | |||
| Formule brute | ClCu CuCl | ||
| Masse molaire | 98,999 ± 0,005 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 426 °C (703 K) | ||
| T° ébullition | 1 490 °C (1760 K) (décomp.) | ||
| Solubilité | 0,062 g·l-1 d'eau (20 °C) | ||
| Masse volumique | 4,145 g·cm-3 | ||
| Point d’éclair | inflammable | ||
| Cristallographie | |||
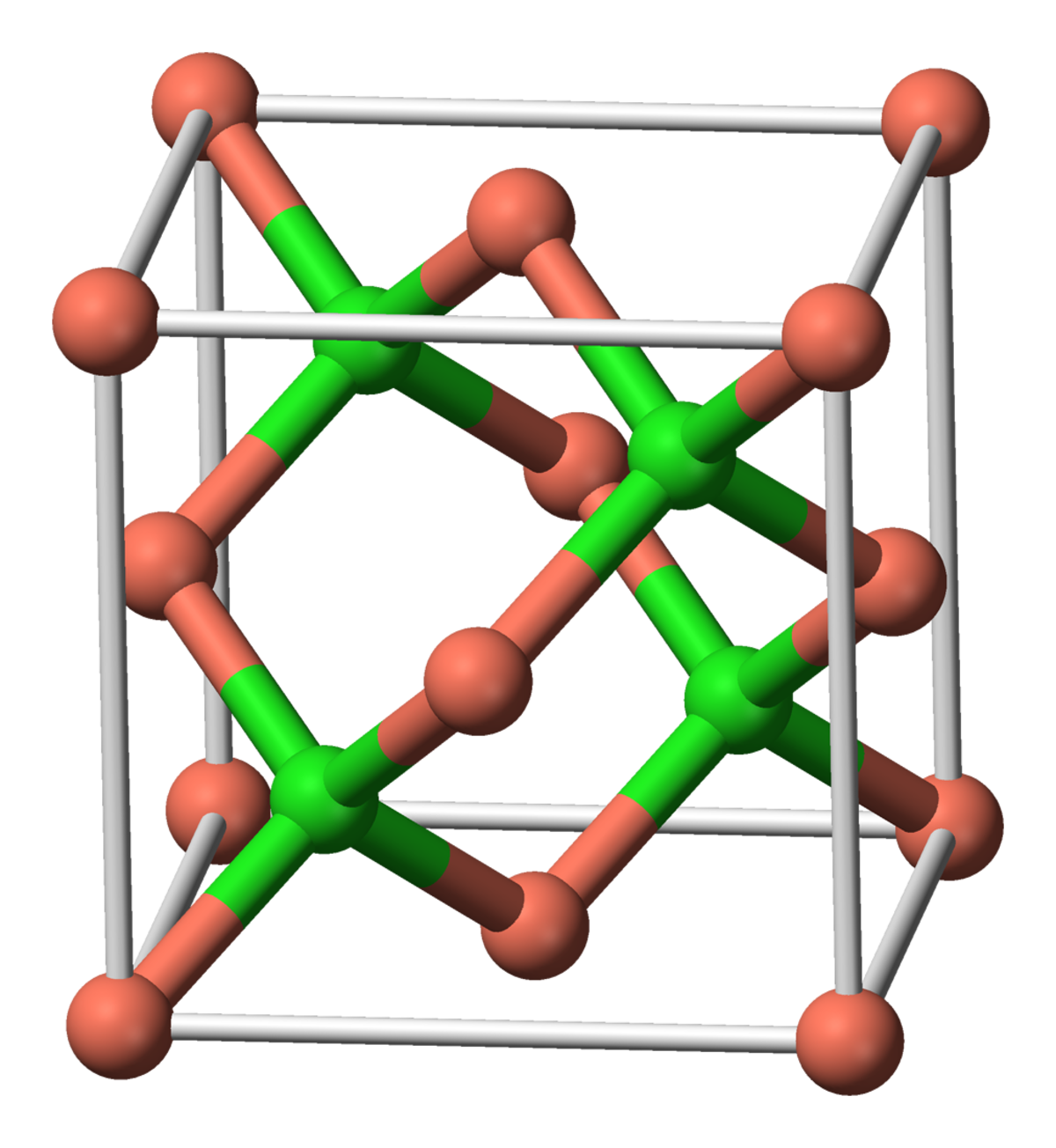
| Structure type | Zinc blende structure | ||
| Propriétés optiques | |||
| Indice de réfraction | 1.930 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 22, 50/53, | |||
| Phrases S : 2, 22, 60, 61, | |||
| | |||
|
0 3 0 | |||
| Écotoxicologie | |||
| DL | 140 mg·kg-1 | ||
| | |||
Le chlorure de cuivre(I), communément appelé chlorure cuivreux est le plus bas chlorure du cuivre avec la formule CuCl. Ce solide incolore est un précurseur versatile de nombreux autres composés du cuivre dont certains d'une importance commerciale. Il apparaît naturellement dans le minerai rare, la nantokite (en). Contrairement aux autres halogénures de métaux de transition de la première ligne, il forme des complexes stables avec le monoxyde de carbone (CO). Il cristallise dans un motif diamantoïde (en) qui reflète la tendance du cuivre(I) de former des complexes tétrahédriques.
Propriétés
CuCl est plus facilement disponible et moins toxique que d'autres acides de Lewis doux. De plus, le cuivre présente de nombreux degrés d'oxydation tels que I, II et III. La combinaison de ces propriétés définit certains des usages du chlorure cuivreux. C'est un acide de Lewis doux. Ainsi, il tend à former des complexes stables avec des bases de Lewis douces comme la triphénylphosphine:
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
bien que CuCl soit insoluble dans l'eau, il se dissous dans des solutions aqueuses contenant des molécules donneuses adéquates. Il forme des complexes avec les ions halogénures, par exemple H3O+ CuCl2- dans l'acide chlorhydrique concentré. Il se dissous aussi dans des solutions contenant des cyanures (CN-) ou des thiosulfates (S2O32-) ou de l'ammoniac (NH3) et forme alors des complexes.
Cependant, ses solutions aqueuses sont instable vis à vis de la dismutation en cuivre et chlorure de cuivre (II) (CuCl2). Ceci explique en particulier la couleur verdâtre des échantillons comme le montre la photo dans la chimiebox.
Ses solutions dans l'acide chlorhydrique ou ammoniacales absorbent le monoxyde de carbone pour former des complexes incolores comme le dimère à pont chlorure, [CuCl(CO)]2. Les même solutions dans l'acide chlorhydrique peuvent réagir avec l'éthyne (HC≡CH) pour former [CuCl(C2H2)] tandis que les solutions ammoniacales forme de l'éthylénure de cuivre (I) , explosif. Les complexes de CuCl avec des alcènes peuvent être préparés par réduction du chlorure de cuivre (II) (CuCl2) avec le dioxyde de soufre (SO2) en solution alcoolique et en présence d'alcènes. Les complexes avec des diènes comme le 1,5-cyclooctadiène sont particulièrement stables:




















































