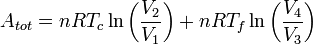Cycle de Carnot - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
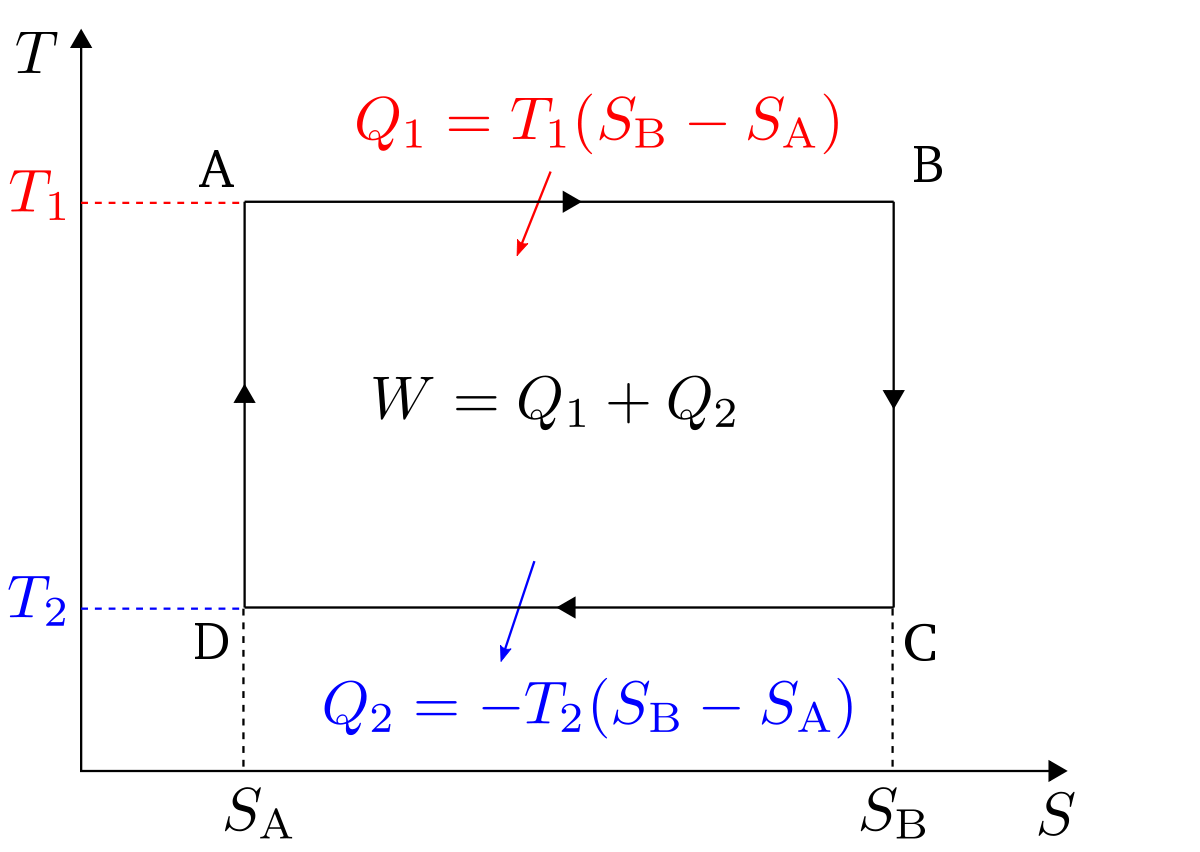
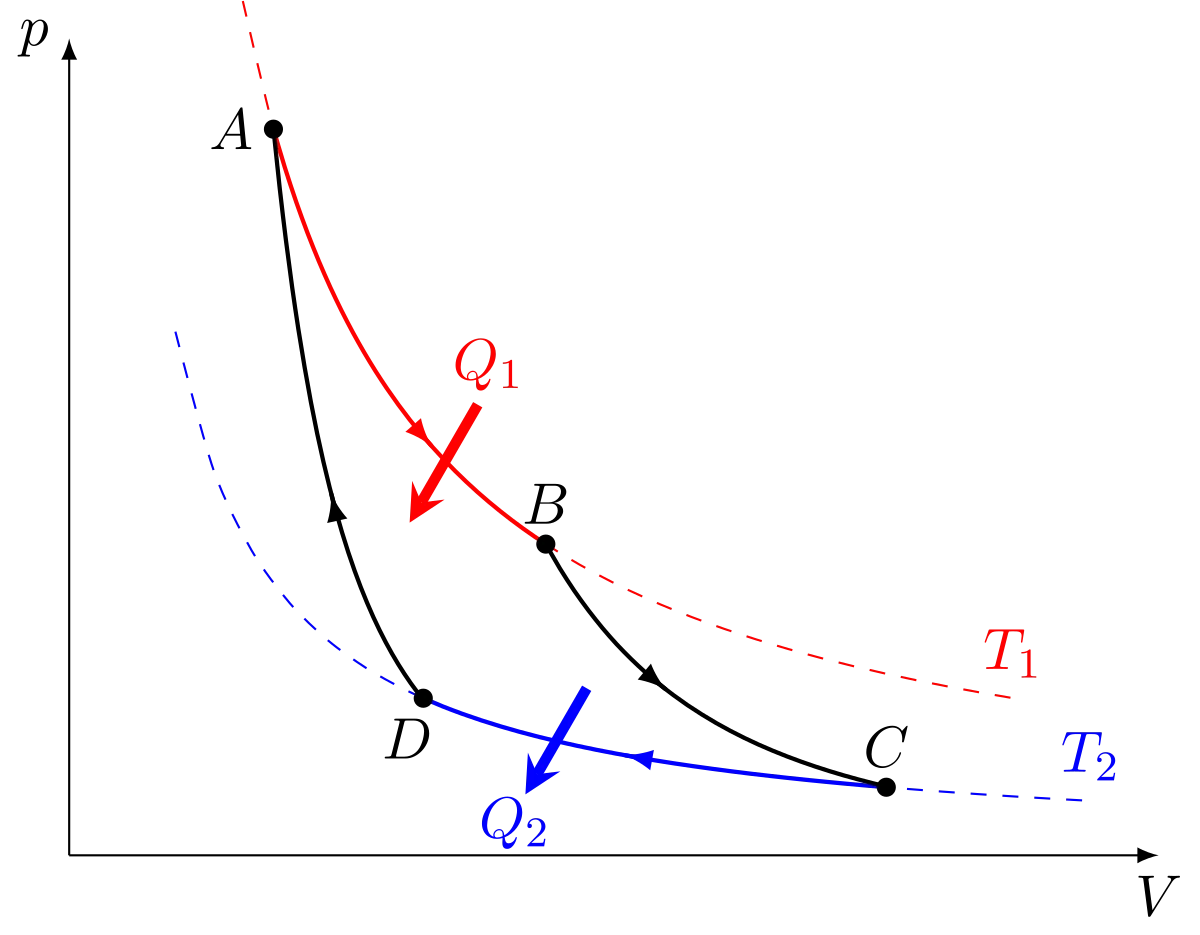
Le cycle de Carnot est un cycle thermodynamique idéal constitué de quatre processus réversibles : une détente isotherme, une détente adiabatique (donc isentropique car réversible), une compression isotherme, et une compression adiabatique. C'est le cycle le plus efficace pour obtenir du travail à partir de deux sources de chaleur de températures constantes ; le cycle inverse est le moyen le plus efficace de transférer de la chaleur d'une source froide à une source chaude à partir d'une source de travail. L'efficacité des autres cycles et des machines réelles est comparé à celui du cycle de Carnot par le biais du rendement, un nombre sans dimension entre 0 (efficacité nulle) et 1 (efficacité du cycle de Carnot).
Il fut publié par Sadi Carnot en 1824 dans son unique ouvrage Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance et permit d'ouvrir la voie à la formulation du second principe de la thermodynamique.
Description du cycle
Carnot cherchait à faire un cycle avec la meilleure efficacité possible. Ainsi chaque efficacité d'une machine thermodynamique peut être comparée avec l'efficacité du cycle de Carnot. Il sert de cycle de référence.
Le cycle est composé de 4 processus ( 2 isothermes et 2 adiabatiques réversibles) :
- 1 : Compression adiabatique réversible
- 2 : Détente isotherme
- 3 : Détente adiabatique réversible
- 4 : Compression isotherme
Le deuxième principe de la thermodynamique permet d'établir pour une transformation réversible (car le fluide est à la température de la source) l'égalité de Clausius-Carnot :

avec:
- Qf transfert thermique avec la source froide (compté négativement).
- Qc transfert thermique avec la source chaude (compté positivement).
- Tf température absolue de la source froide.
- Tc température absolue de la source chaude.
L'efficacité de Carnot

De nombreux systèmes thermodynamiques ont une efficacité définie à partir de celui du Cycle de Carnot, qui est un cycle purement théorique. En notant A l'aire géométrique de la transformation dans le diagramme de Clapeyron, c'est-à-dire l'opposé du travail W reçu par le système décrivant le cycle, on a :
A = − W = A1,2 + A2,3 + A3,4 + A4,1 et Qc = transfert thermique avec la source chaude, toutes les deux définies positives.
Donc pour chaque processus, en supposant que le fluide décrivant le cycle est un gaz parfait avec

- 1-2 :
-

- ΔU1,2 = 0 car isotherme
-
- 2-3 :
- Q2,3 = 0 = A2,3 + ΔU2,3
- d'où :

- 3-4 :
-

- ΔU3,4 = 0 car isotherme
-
- 4-1 :
- Q4,1 = 0 = A4,1 + ΔU4,1
- d'où :

Donc, en tenant compte de


Nous avons également les formules de Laplace pour les processus processus isentropiques (donc ici les adiabatiques réversibles) :

- 4-1 :
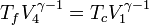
- 2-3 :

Et donc le rapport :



En incorporant ceci dans l'équation de l'efficacité on obtient :

On voit donc qu'il est impossible d'obtenir une efficacité de 100%, même pour le cycle de Carnot moteur entièrement réversible, sauf pour le cas théorique