Nomenclature des molécules organiques - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La nomenclature en chimie est l'ensemble des règles, symboles, vocables, destinés à représenter et à prononcer les noms des corps étudiés.
L'objectif essentiel d'une nomenclature est d'aboutir à des noms de composés chimiques sans ambiguïté, à savoir qu'un même nom ne doit jamais servir à désigner deux composés chimiques différents. Par contre, un même composé chimique suffisamment complexe peut recevoir plusieurs noms différents provenant de différentes nomenclatures, ou même parfois provenant de la même nomenclature.
La nomenclature officielle en chimie organique est la nomenclature IUPAC (Union internationale de chimie pure et appliquée).
Généralités
La connaissance d'une espèce en chimie organique revêt deux aspects :
- La structure qui est celle de la molécule, définie par la position relative dans l'espace des différents atomes (aspect statique).
- La réactivité, liée a la structure, qui rend compte du comportement vis à vis d'autres molécules (aspect dynamique).
Structure des molécules
Une molécule organique est composée :
- d'un squelette carboné constitué par des enchaînements carbonés aux formes diverses (chaîne, cycle, ...).
- de groupes fonctionnels caractéristiques des fonctions chimiques (alcool, acide, amine, etc.)
Pour chaque molécule, il faut établir la structure en s'appuyant sur des faits expérimentaux (preuves chimiques et spectroscopiques) et proposer une représentation par un symbolisme qui rend compte des différents types de liaison entre les atomes (double et triple liaisons, cycle) et aussi de la structure spatiale.
Historique des tentatives de nomenclatures
Le besoin d'une nomenclature s'est fait particulièrement ressentir à la fin du XIXe siècle, devant les progrès de la chimie et le nombre de plus en plus important de molécules connues. Une commission internationale a été formée en 1889, composées principalement de français. Elle parvient à en finaliser des règles lors du congrès de Genève de 1892, connue sous le nom de nomenclature de Genève. Elle ne prend cependant pas en compte les molécules aromatiques, ni les composés ayant plusieurs fonctions.
Cette première nomenclature est précisée et complétée en 1930 sous le nom de nomenclature de Liège. Celle-ci sera amendée au cours de différents congrès internationaux, aboutissant à une nouvelle version, publiée en 1958 sous le nom de nomenclature de Paris.
Dérivés fonctionnels des hydrocarbures
Les fonctions organiques sont signalées dans la composition du nom d'un dérivé polyfonctionnel d'hydrocarbure soit par un préfixe soit par un suffixe.
- La fonction principale est en suffixe.
- Toutes les autres fonctions sont en préfixe selon une hierarchie définie.
Fonctions organiques toujours signalées en préfixe
| Fonction | Préfixe |
|---|---|
| -Br | bromo |
| -Cl | chloro |
| -N=N- | diazo |
| CH3CH2O- | éthoxy |
| -F | fluoro |
| -I | iodo |
| CH3O- | méthoxy |
| -NO2 | nitro |
| -NO | nitroso |
Noms des hydrocarbures
Alcanes
Les alcanes sont des hydrocarbures saturés (simples liaisons uniquement), linéaires (sans cycle) de formule brute CnH2n+2.
| n | alcane | R-H | reste | formule CnH2n+2 | alkyle R | formule du reste | abréviation |
|---|---|---|---|---|---|---|---|
| 1 | méth | ane | CH4 | méth | yle | CH3- | Meth(a) |
| 2 | éth | ane | CH3CH3 | éth | yle | CH3CH2- | Eth(a) |
| 3 | prop | ane | CH3CH2CH3 | prop | yle | CH3CH2CH2- | Prop(a) |
| 4 | but | ane | CH3(CH2)2CH3 | but | yle | CH3(CH2)2CH2- | But(a) |
| 5 | pent | ane | CH3(CH2)3CH3 | pent | yle | CH3(CH2)3CH2- | Pent(a) |
| 6 | hex | ane | CH3(CH2)4CH3 | hex | yle | CH3(CH2)4CH2- | Hex(a) |
| 7 | hept | ane | CH3(CH2)5CH3 | hept | yle | CH3(CH2)5CH2- | Hept(a) |
| 8 | oct | ane | CH3(CH2)6CH3 | oct | yle | CH3(CH2)6CH2- | Oct(a) |
| 9 | non | ane | CH3(CH2)7CH3 | non | yle | CH3(CH2)7CH2- | Non(a) |
| 10 | déc | ane | CH3(CH2)8CH3 | déc | yle | CH3(CH2)8CH2- | Déc(a) |
| 11 | undéc† | ane | CH3(CH2)9CH3 | undéc | yle | CH3(CH2)9CH2- | ? |
| 12 | dodéc | ane | CH3(CH2)10CH3 | dodéc | yle | CH3(CH2)10CH2- | ? |
| 13 | tridéc | ane | CH3(CH2)11CH3 | tridéc | yle | CH3(CH2)11CH2- | ? |
| 14 | tétradéc | ane | CH3(CH2)12CH3 | tétradéc | yle | CH3(CH2)12CH2- | ? |
| 15 | pentadéc | ane | CH3(CH2)13CH3 | pentadéc | yle | CH3(CH2)13CH2- | ? |
| 16 | hexadéc | ane | CH3(CH2)14CH3 | hexadéc | yle | CH3(CH2)14CH2- | ? |
| 17 | heptadéc | ane | CH3(CH2)15CH3 | heptadéc | yle | CH3(CH2)15CH2- | ? |
| 18 | octadéc | ane | CH3(CH2)16CH3 | octadéc | yle | CH3(CH2)16CH2- | ? |
| 19 | nonadéc | ane | CH3(CH2)17CH3 | nonadéc | yle | CH3(CH2)17CH2- | ? |
| 20 | icos ‡ | ane | CH3(CH2)18CH3 | icos | yle | CH3(CH2)18CH2- | ? |
| 21 | hénicos | ane | CH3(CH2)19CH3 | hénicos | yle | CH3(CH2)19CH2- | ? |
| 22 | docos | ane | CH3(CH2)20CH3 | docos | yle | CH3(CH2)20CH2- | ? |
| 23 | tricos | ane | CH3(CH2)21CH3 | tricos | yle | CH3(CH2)21CH2- | ? |
| 30 | triacont | ane | CH3(CH2)28CH3 | triacont | yle | CH3(CH2)28CH2- | ? |
| 31 | hentriacont | ane | CH3(CH2)29CH3 | hentriacont | yle | CH3(CH2)29CH2- | ? |
| 32 | dotriacont | ane | CH3(CH2)30CH3 | dotriacont | yle | CH3(CH2)30CH2- | ? |
| 33 | tritriacont | ane | CH3(CH2)31CH3 | tritriacont | yle | CH3(CH2)31CH2- | ? |
| 40 | tétracont | ane | CH3(CH2)38CH3 | tétracont | yle | CH3(CH2)38CH2- | ? |
| 50 | pentacont | ane | CH3(CH2)48CH3 | pentacont | yle | CH3(CH2)48CH2- | ? |
| 60 | hexacont | ane | CH3(CH2)58CH3 | hexacont | yle | CH3(CH2)58CH2- | ? |
| 100 | hect | ane | CH3(CH2)98CH3 | hect | yle | CH3(CH2)98CH2- | ? |
| 132 | dotriacontahect | ane | CH3(CH2)130CH3 | dotriacontahect | yle | CH3(CH2)130CH2- | ? |
† La forme hendécane n'est pas recommandée. ‡ La forme "éicos-" est désuète [1].
Alcanes ramifiés ou alkylalcanes
Ils sont constitués :
- d'un alcane de base qui est celui qui possède la chaîne hydrocarbonée la plus longue ;
- de ramifications alkyles (chaînes hydrocarbonées plus courtes) qui peuvent à leur tour être ramifiés.
Pour nommer un hydrocarbure ramifié, on désigne les chaînes latérales par des préfixes accolés au nom de l'hydrocarbure de base.
Nommer un alkylalcane dont la formule est donnée
- trouver la chaîne hydrocarbonée la plus longue à considérer comme l'alcane de base et lui donner un nom
- identifier tout groupe alkyl branché sur l'alcane et lui donner un nom (radical); placer ce nom en préfixe devant le nom de l'alcane de base en respectant l'ordre alphabétique.
- faire précéder le nom de chaque radical par un chiffre indiquant la position de la ramification sur l'alcane de base ; la numérotation de l'alcane de base se fait d'un bout à l'autre de façon à ce que la somme des indices soit la plus faible possible. L'indice (il y en a autant que de ramifications) est toujours placé devant le nom auquel il se réfère.
Exemple
- 3-éthyl-4-méthylheptane
Fichier:3-ethyl-4-methylheptane.jpg
- En cas de choix de numérotation des substituants, on doit donner l'indice le plus bas au radical prioritaire par ordre alphabétique.
Écrire la formule chimique d'un alcane dont le nom est donné
- écrire autant de carbones que l'exige le nom de l'alcane de base et numéroter chacun de ses atomes ;
- faire de même avec les radicaux en les positionant sur l'alcane de base selon le numero du carbone porteur sur l'alcane de base.
Principaux radicaux ramifiés
Autres radicaux
Les cycloalcanes
Les alcanes monocycliques de formule brute CnH2n sont nommés en faisant précéder du préfixe cyclo le nom de l'alcane.
Exemples : cyclobutane, cycloheptane, 1,1,3-triméthylcyclopentane.
Les alcanes bicycliques prennent le nom de l'alcane linéaire de même nombre de carbones précédé du préfixe bicyclo. Après ce préfixe, on met entre crochets le nombre d'atomes de carbone de chacun des 3 ponts, on numérote les atomes du cycle à partir d'une tête de pont en numérotant en premier la chaine la plus longue conduisant à l'autre tête de pont, on continue en numérotant la chaine moyenne en revenant vers la première tête de pont puis on termine par la plus courte.
Exemples :
Les hydrocarbures insaturés
On parle d'hydrocarbure insaturé lorsque certaines liaisons entre les atomes de carbone du squelette carboné sont doubles ou même triples, les autres étant simples
Les alcènes
Formule brute de la forme CnH2n pour les chaines portant 1 seule double liaison (pour plusieurs doubles liaisons cette formule n'est pas utilisable).
Les alcènes contiennent au moins une liaison C-C double. Le nom d'un alcène est calqué sur celui des alcanes : le suffixe -ane est remplacé par le suffixe -ène et la position de la double liaison doit être précédée d'un indice de position le plus bas pour le premier carbone de la liaison. Les hydrocarbures portant 2 doubles liaisons sont appelés alcadiènes.
Exemples
- CH3-CH2CH=CH2 but-1-ène
- CH3CH=CHCH2CH=CHCH3 hepta-2-5-diène
Groupes dérivés des alcènes
- les groupes alcényles
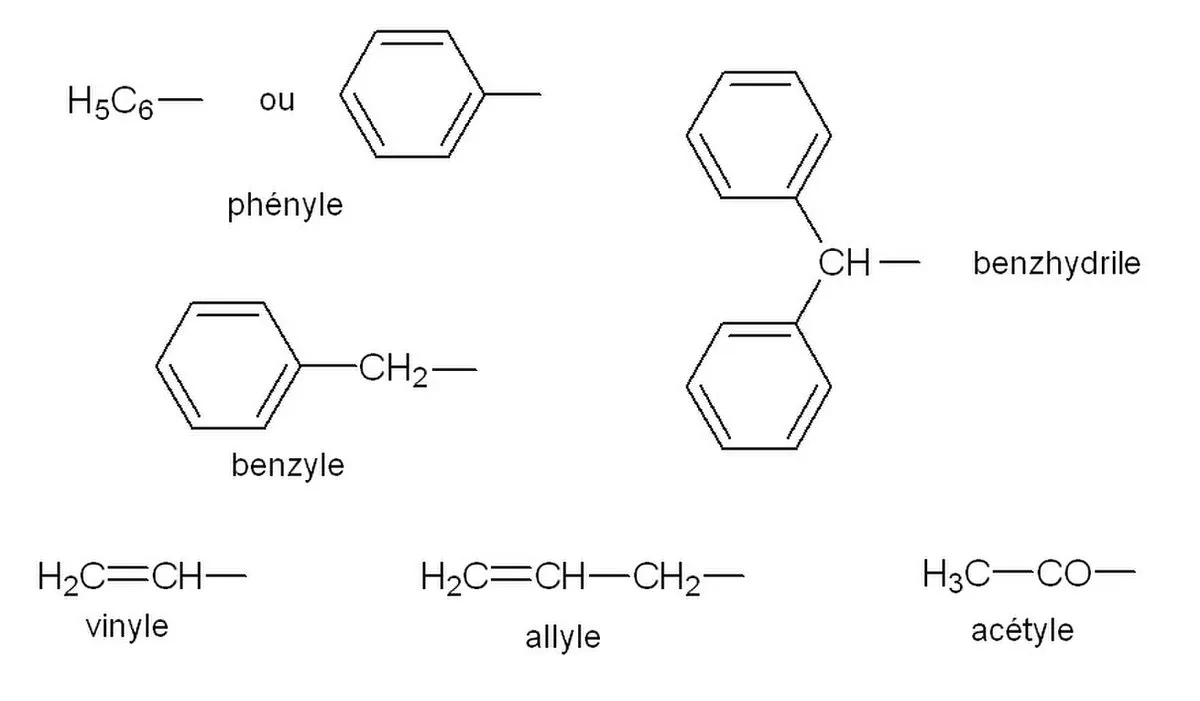
- CH2=CH- éthényle ou vinyle
- CH2=CH-CH2- prop-2-ényle ou allyle
- Les groupes alkylidènes
- CH3CH= éthylidène
- les groupes alkylènes : groupes divalents dérivés des alcanes par élimination d'un hydrogène à chaque extrémité de la chaine
- -CH2- méthylène
- -CH=CH- vinylène
Les alcynes
Les alcynes contiennent au moins une liaison C-C triple. Le nom d'un alcyne est obtenu à partir du nom de l'alcane en remplaçant le suffixe -ane par le suffixe -yne. La numérotation des carbones s'effectue de la même façon que pour les alcènes.
Exemples d'alcènes et d'alcynes
Les hydrocarbures aromatiques
Les plus courants sont en général dérivés du benzène.
Les hydrocarbures désignés par un nom trivial
Exemples :
Cas des dérivés du benzène disubstitué
- en position 1,2 position ortho (o)
- en position 1,3 position méta (m)
- en position 1,4 position para (p)
Exemples : o-dichlorobenzène, p-bromotoluène.
Les hydrocarbures aromatiques forment des groupes aryles :
Avec dans l'ordre de gauche à droite : le reste phényle, le groupe p-phénylène, le reste benzyle.
Les hydrocarbures polycycliques
Exemples des plus connus :