Picoplancton photosynthétique - Définition
La liste des auteurs de cet article est disponible ici.
Méthodes d'étude
Sa très petite taille rend le picoplancton difficile à étudier par les méthodes classiques, dont la microscopie optique. On a donc recours à d'autres méthodes ;
- Microscopie à épifluorescence. Elle permet de compter certains groupes de cellules possédant des pigments fluorescents tels que Synechococcus qui possède phycoérythrine.
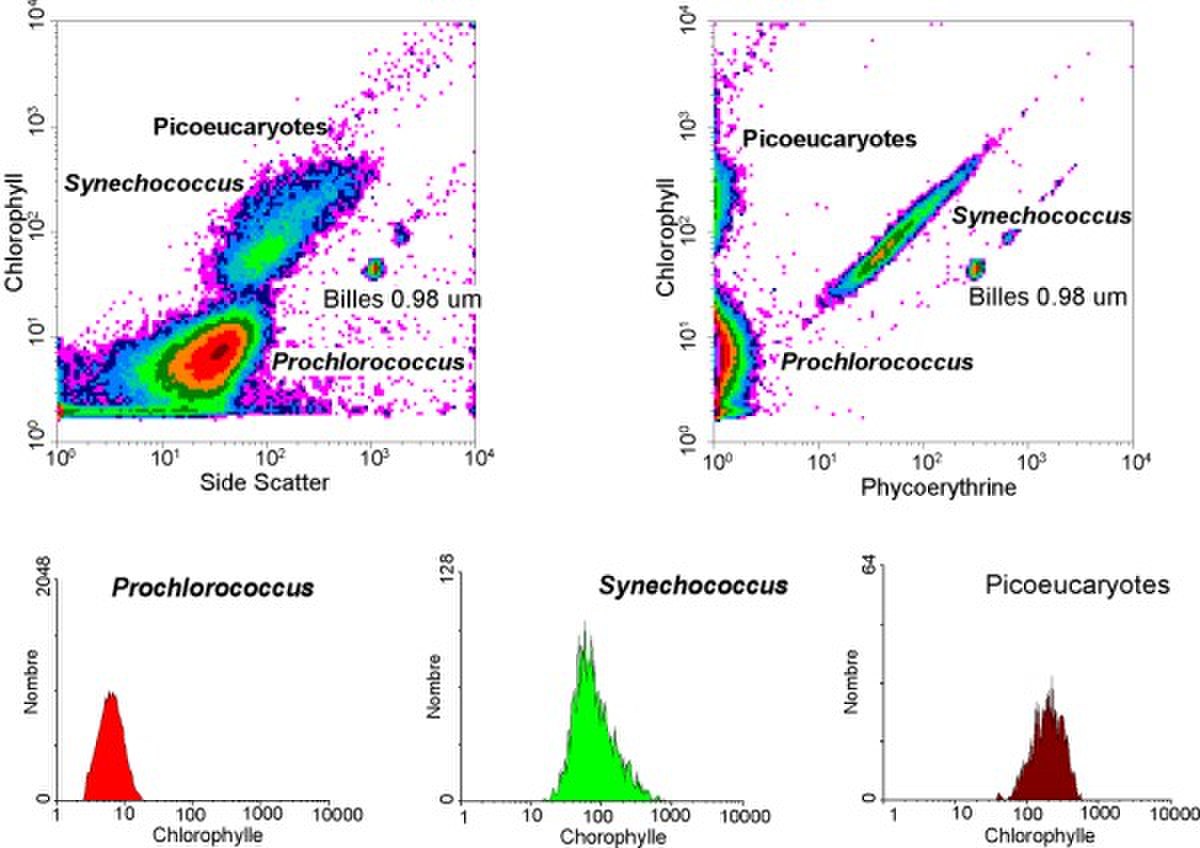
- Cytométrie en flux. Elle permet de mesurer la taille ("side scatter" en anglais) et la fluorescence sur 1 000 à 10 000 cellules par seconde, facilitant la mesure de la concentration des différentes populations picoplanctoniques sur des échantillons marins. Trois groupes de cellules (Prochlorococcus, Synechococcus et picoeucaryotes) peuvent être distinguées. AinsiSynechococcus est caractérisé par la double fluorescence de ses pigments : orange pour la phycoérythrine et rouge pour la chlorophylle. La cytométrie en flux permet aussi un tri de populations spécifiques (par exemple Synechococcus) pour les cultiver ou en faire des analyses détaillées.
- Analyse des pigments photosynthétiques tels que la chlorophylle ou les caroténoïdes par chromatographie haute précision (HPLC). Elle permet de déterminer les différents groupes d'algues d'un échantillon.
- Biologie moléculaire :
-
- Clonage et séquençage de gènes tel que celui de l'ARN ribosomique. Ils permettent de déterminer la diversité totale d'un échantillon.
- DGGE (Denaturing Gradient Gel Electrophoresis), plus rapide que la technique précédente, il donne une idée de la diversité globale d'un échantillon.
- Hybridation in situ (FISH) Elle utilise des sondes fluorescentes reconnaissant des taxons précis (espèce, genre ou classe....
- PCR en temps réel Elle permet de déterminer (comme le FISH) l'abondance de groupes précis et d'analyser rapidement d'un grand nombre d'échantillons, mais demande plus de contrôles.
Ecologie
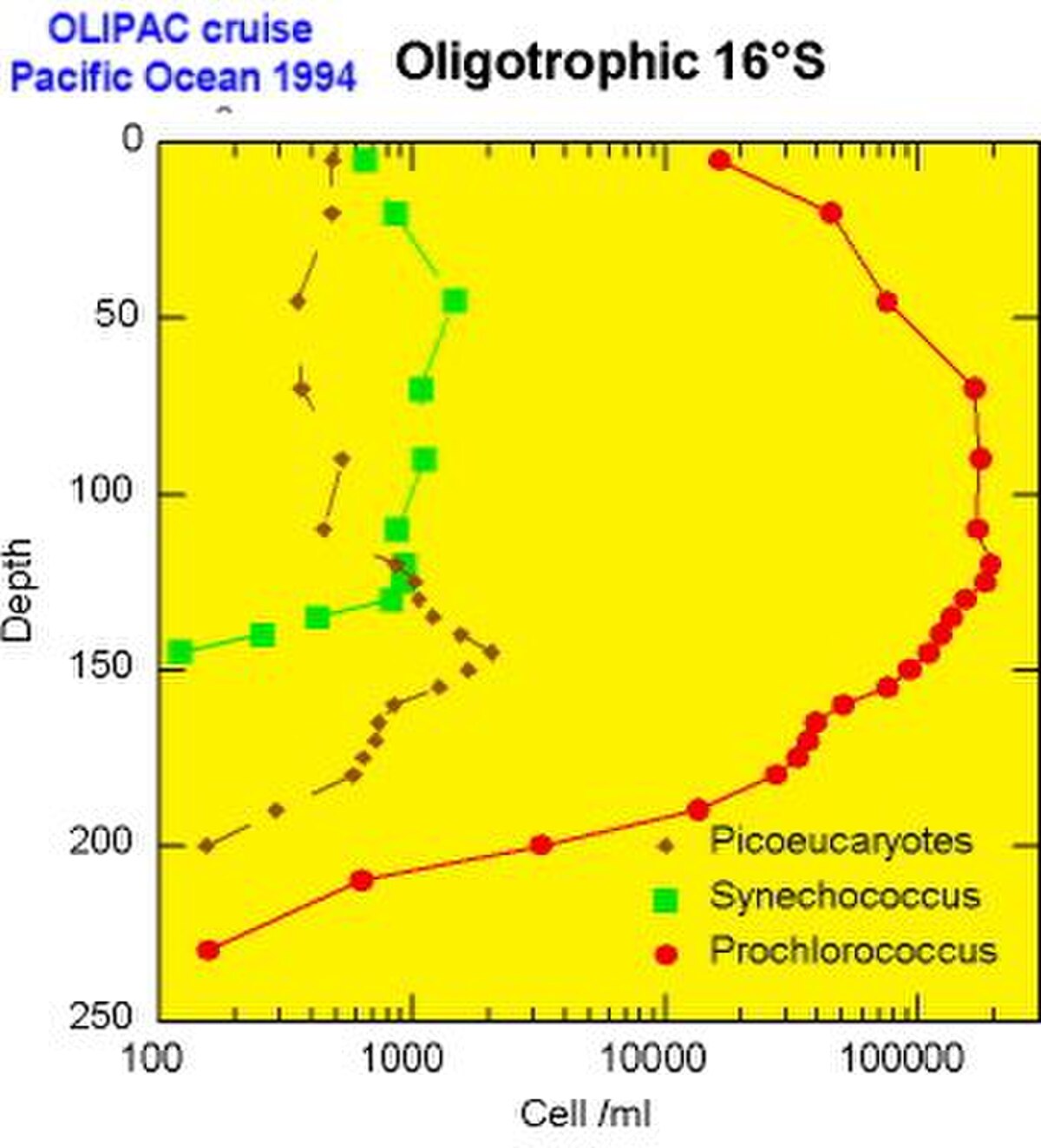
Chaque population picoplanctonique occupe une niche écologique différente dans le milieu océanique. Les populations de picoplancton semblent régulées non seulement par la prédation, mais aussi par de très virus spécifiques que l'on commence seulement à découvrir, et que certains classent dans le nanoplancton et plus précisément dans le Femtoplancton (<0,2 μm), bien qu'ils ne soient généralement pas considérés comme des organismes vivant.
- La cyanobactérie Synechococcus est en général abondante dans les milieux mésotrophes par exemple au voisinage de la Remontée d'eau (« upwelling ») équatoriale ou en milieu côtier
- Prochlorococcus remplace Synechococcus dès que le milieu s'appauvrit (c.a.d. devient oligotrophe). Par contre en région tempérée (par exemple dans l'Atlantique Nord), Prochlorococcus est absent car les eaux trop froids ne favorisent pas son développement.
- Quant aux eucaryotes, à leur diversité taxonomique encore mal connue, correspond sans doute une grande diversité d'habitats. En milieu océanique, on les trouve cependant souvent en profondeur à la base de la couche éclairée (couche euphotique). En milieu côtier, certaines espèces de picoeucaryotes tels que Micromonas dominent. Leur abondance suit un cycle saisonnier, comme le plancton de plus grande taille, avec un maximum en été.
Il y a une trentaine d'année on faisait l'hypothèse que la vitesse de division des micro-organismes dans les écosystèmes océaniques centraux était très faible, de l'ordre de la semaine ou du mois. Cette hypothèse était confortée par le fait que la biomasse (estimée par exemple par le contenu en chlorophylle) était très stable au cours du temps. Cependant avec la découverte du picoplancton, on s'est aperçu que le système était beaucoup plus dynamique qu'il n'y paraissait. En particulier, on a découvert l'ubiquité de minuscules prédateurs d'une taille de quelques microns qui ingéraient les algues picoplanctoniques aussi rapidement qu'elles étaient produites. Ce système prédateur-proie extrêmement sophistiqué est pratiquement toujours à l'équilibre et résulte en une biomasse quasi-constante. Cette parfaite adéquation entre production et consommation rend cependant extrêmement difficile la mesure précise de la vitesse du système.
En 1988, deux chercheurs américains, Carpenter et Chang avaient proposé d'estimer la vitesse de division des cellules du phytoplancton à partir du suivi de la réplication de l'ADN par microscopie. En remplaçant la microscopie par la cytométrie en flux, il est possible suivre le contenu en ADN des cellules de picoplancton (par exemple Prochlorococcus) au cours du temps. On s'est alors aperçu que les cellules du picoplancton sont extrêmement synchrones : elles répliquent leur ADN puis se divisent toutes en même temps en fin de journée. Cette synchronisation pourrait être due à la présence d'une horloge cellulaire interne.
Le picoplancton occupe une place encore mal évaluée dans les réseaux trophiques.