Protéines LSm - Définition
La liste des auteurs de cet article est disponible ici.
Caractéristiques
Les LSm sont caractérisées par un feuilletage β (structure secondaire), replié sur lui même (structure tertiaire), rassemblé en six ou sept unités (structure quaternaire) et se liant à des oligonucléotides d'ARN.
Structure secondaire
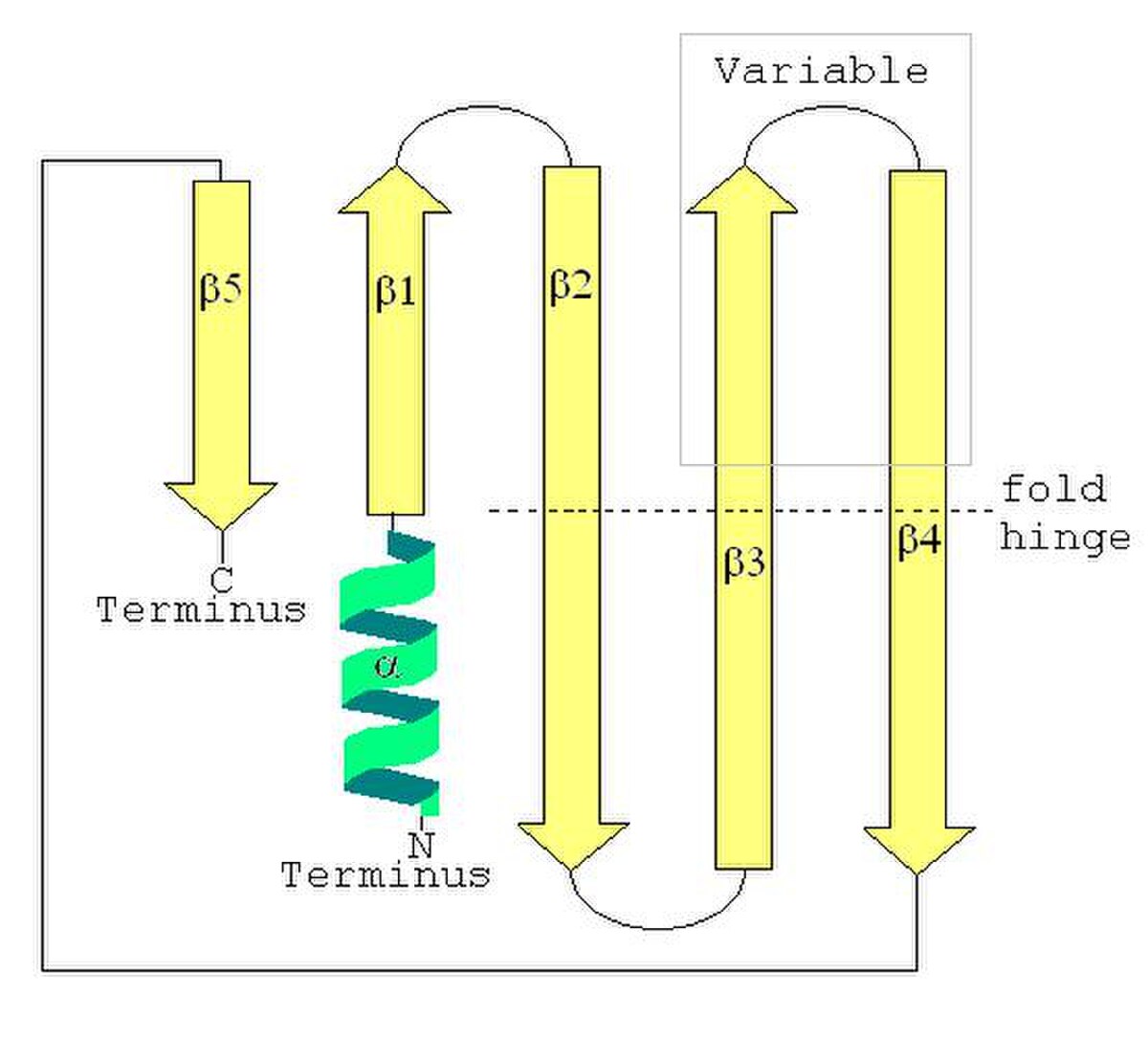
La structure secondaire d'une protéine LSm est un feuillet de cinq brins anti-parallèles β, avec les brins identifiés à partir de l'extrémité N-terminale vers l'extrémité C-terminale par β1, β2, β3, β4, β5. La séquence de motifs Sm1 correspond aux brins β1, β2, β3 et la séquence Sm2 correspond aux brins β4 et β5. Les quatre premiers brins β sont adjacents entre eux, mais β5 est adjacent à β1, transformant la structure d'ensemble en un court cylindre. Cette topologie structurelle est décrite comme 51234. De courte longueur (deux à quatre tours de spire) l'hélice α N-terminale est également présente dans la plupart des LSm. Les brins β3 et β4 sont courts dans certaines LSm et séparés par un portion non structurés de longueur variable. Les brins β2, β3 et β4 sont courbés à 120° en leur milieu, les coudes correspondant souvent à la présence de glycine et les chaînes latérales internes au cylindre à des résidus hydrophobes: valine, leucine, isoleucine et méthionine.
Structure tertiaire
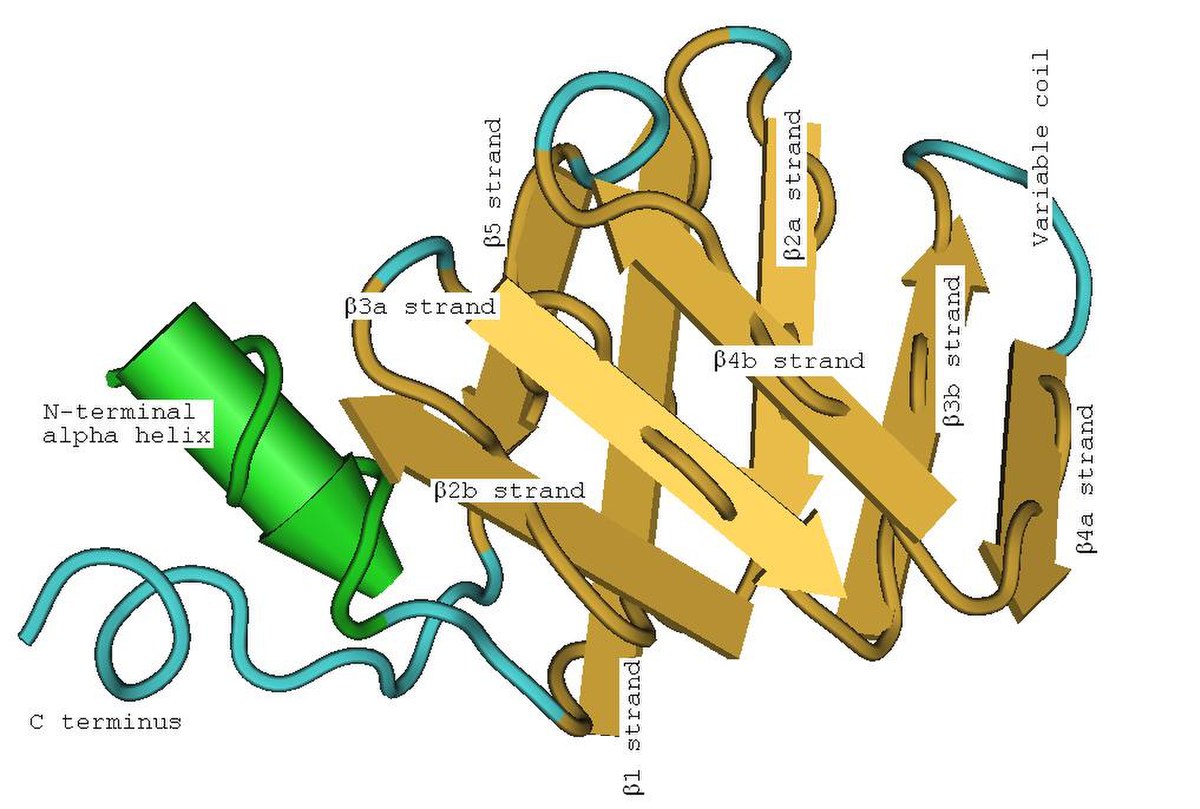
Le structure tertiaire en tonneau des LSm est due aux brins β2, β3 et β4 fortement courbés (environ 120°) et au brin β1 qui vient fermer l'anneau avec le brin β5. Pour bien comprendre cette structure tertiaire, on peut imaginer dérouler l'anneau et se représenter une structure plane. Chaque brin β plié peut être considéré comme deux brins βa et βb plus courts. Le pliage de la LSm peut alors être considéré comme un pliage en deux plans (on parle de pliage en sandwich) de huit brins β anti-parallèles, avec cinq brins dans un plan et les trois autres dans un plan parallèle, les brins du premier plan faisant un angle d'environ 45° avec ceux du second. L'hélice α est placée à une extrémité du sandwich. L'hélice et les brins peuvent être étiquetés (de l'extrémité N-terminale à l'extrémité C-terminale) α, β1, β2a, β2b, β3a, β3b, β4a, β4b, β5 où les a et b se référent aux deux moitiés d'un brin tordu. Chacun des huit brins β est formé de cinq résidus d'acides aminés. En comptant les coudes, les boucles entre les brins et l'hélice α, environ 60 acides aminés contribuent à la formation d'une LSm, mais ce nombre varie entre homologues en raison de variations dans les boucles inter-brins, l'hélice α et même les longueurs des brins β3b et β4a.
Structure quaternaire
Les monomères de LSm s'assemblent en général en un anneau formé de six ou sept unités, tore d'environ 7 nanomètres de diamètre avec un trou de 2 nanomètres. Les LSm ancestrales sont des homohexamères ou homoheptamères c'est-à-dire que les 6 ou 7 unités du tore sont identiques. Chez les eucaryotes, on a affaire à des hétéroheptamères formés de sept unités toutes différentes, comme les protéines Sm par exemple. On comprendra mieux les liaisons entre les unités si l'on se rappelle, la description déroulée faite au paragraphe précédent. Les cinq brins β du premier plan d'une unité s'apparient avec les trois brins du second plan de l'unité adjacente, formant un feuillet torsadé Aβ4a/Aβ3b/Aβ2a/Aβ1/Aβ5/Bβ4b/Bβ3a/Bβ2b, où A et B se rapportent aux deux unités différentes. En plus des liaisons hydrogène entre les brins Aβ5 and Bβ4b des deux unités, il y a des contacts énergétiques favorables entre les chaînes latérales hydrophobes d'acides aminés à l'intérieur de la zone de contact et d'autres entre les chaînes latérales hydrophiles à la périphérie de l'aire de contact.
Liaison à l'ARN
Les anneaux de LSm forment des complexes avec des oligonucléotides d'ARN qui varient de liaisons fortes donnant des complexes très stables (tels que les snRNP de classe Sm) à des liaisons faibles de complexes transitoires. Pour autant que l'on connaisse les détails de ces liaisons, l'ARN se place généralement à l'intérieur du trou du tore LSm, un seul nucléotide étant fixé à une unité LSm, mais on a noté aussi d'autres liaisons des nucléotides avec l'extrémité (côté hélice α) des protéines. La nature chimique exacte de ces liaisons est variable, mais on a notamment des empilements alternés de base azotée (souvent de l'uracile) entre deux acides aminés des chaînes latérales, des liaison hydrogènes entre acides aminés et base azotée et/ou ribose, et des ponts salins entre acides aminés et groupement phosphate.