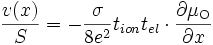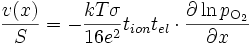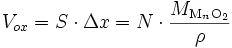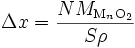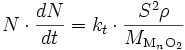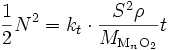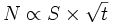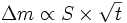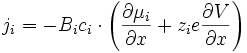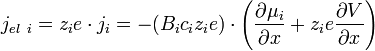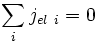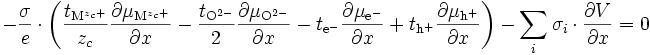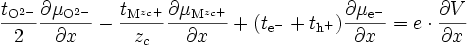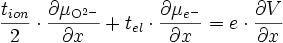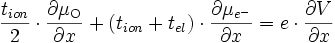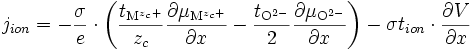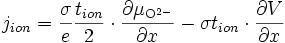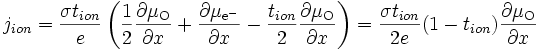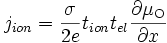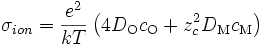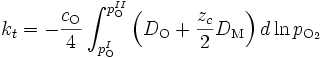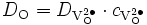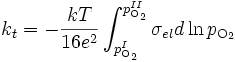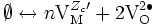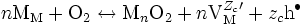Théorie de la cinétique d'oxydation de Wagner - Définition
La liste des auteurs de cet article est disponible ici.
Vitesse de croissance
D'après () et (), on a :
où v(x) est le nombre de cellules de MnO2 crées en une seconde à la profondeur x par rapport à la surface (toutes les grandeurs sont en effet locales).
En remplaçant l'activité de l'oxygène par la pression partielle de dioxygène
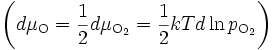
En intégrant cette équation sur l'épaisseur Δx de la couche, on obtient :

|
(19)
où
- N est le nombre de moles d'oxyde ;
- pIO2 et pIIO2 sont les pressions partielles d'oxygène aux interfaces oxyde/gaz et oxyde/métal ;
- kt est le coefficient d'oxydation parabolique.
Si l'on considère que la densité de l'oxyde est uniforme, l'épaisseur Δx de la couche est proportionnelle à la quantité d'oxyde N (Δx ∝ N) : le volume d'oxyde Vox s'écrit
où ρ est masse volumique de l'oxyde et MMnO2 est sa masse molaire. On a donc
et donc
donc en intégrant
puisqu'en début d'oxydation, la quantité d'oxyde est nulle (N = 0 à t = 0), soit
|
|
Comme la prise de masse est due à l'incorporation d'atomes d'oxygène, on a
- Δm = N⋅2⋅MO
où 2 est le nombre d'atomes d'oxygène par maille de MnO2, et MO est la masse molaire de l'oxygène (16 g·mol−1), donc
|
|
Ce sont donc bien des lois paraboliques.
Courant ionique
Les espèces chargées migrent sous l'effet du gradient de potentiel chimique et électrique, donc pour une espèce i () () :
Ce flux crée un courant électrique dont la densité vaut () () () :
soit d'après ():
-
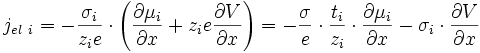
puisque σi = ti·σ.
Le circuit est ouvert : il n'y a pas de circulation de charges à l'extérieur de l'oxyde, on a donc :
soit
Comme on a
-
∑ σi = σ i
et avec (), on obtient :
et d'après () :
-
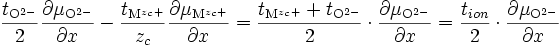
si l'on note le nombre de transport ionique tion = tMzc+ + tO2- et le nombre de transport électrique tel = te- + th+. On obtient :
et d'après ()
comme tion + tel = 1, on obtient
-
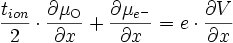
La quantité qui nous intéresse est le courant ionique, qui s'écrit d'après () :
soit d'après ()
en utilisant l'équilibre thermodynamique de l'oxygène () et en remplaçant
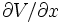
soit
|
|
Cas particuliers
Défauts prédominants et diffusion
Dans le cas général, on a deux défauts dominants : un défaut ionique (dans le sous-réseau d'oxygène ou de métal) et un défaut électronique (électron libre ou trou délectron).
En raison de la neutralité électrique, les défauts doivent avoir une charge de signe opposé, on a donc quatre possibilités :
- lacunes métalliques VMzc ' et des trous d'électron h•, l'oxyde est alors dit « en déficit métallique » ;
- ions métalliques interstitiels Mizc • et électrons libres e', l'oxyde est alors dit « en excès métallique » ;
- lacunes d'oxygène VO2 • et électrons libres e' ; l'oxyde est alors dit « en déficit d'oxygène » ;
- ions oxygène interstitiels Oi2 ' et trous d'électron h• ; l'oxyde est alors dit « en excès d'oxygène ».
Les électrons et trous d'électron étant beaucoup plus rapide que les ions, l'oxyde se comporte comme un semi-conducteur de type P dans les cas 1 et 4, et de type N dans les cas 2 et 3.
Dans certains cas, lorsque que l'oxyde est proche de la stœchiométrie, les deux défauts prédominants peuvent être ioniques et former des défauts de Frenkel VMzc ' + Mi2 • ou VO2 • + Oi2 ', ou des défauts de Schottky VMzc ' + VO2 •.
Du fait de la faible concentration en charges électroniques, le conducteur est de type ionique ; on parle « d'électrolyte solide ».
Dans une couche d'oxyde obtenue par réaction avec l'atmosphère, le type de défaut dominant peut varier en fonction de la profondeur puisque la pression partielle de dioxygène varie.
Les considérations ci-dessus ne sont valables que pour de faibles concentrations de défaut (jusqu'à environ 10−4 par maille, soit un défaut pour 10 000 mailles). Au delà, les défauts interagissent et ne peuvent plus être considérés comme indépendants. Pour des concentrations élevées (fraction supérieure à 10−2), les défaut forment des « associations (ou amas) de défauts » (defect clusters). Un ion interstitiel de charge positive (ion métallique ou impureté) ayant une charge relative opposée à la lacune métallique, la présence d'interstitiels a tendance à stabiliser les lacunes par attraction coulombienne (électrostatique) ; lorsque l'on a a interstitiels entourés de b lacunes, on parle de défaut (b : a). Un exemple simple est l'amas de défauts (4:1) dans le wüstite Fe1-zO (structure NaCl).
Oxyde ayant une conductivité électronique prédominante
On a tel ≈ 1 et tion << 1, soit
- σ⋅tion⋅tel ≃ σ⋅tion = σion
avec
-
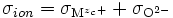
D'après (), on a donc
kt dépend donc des coefficients d'autodiffusion des anions et des cations dans l'oxyde (qui eux-mêmes dépendent de la pression de dioxygène dans l'oxyde) :
Or, les coefficients de diffusion DM et DO s'expriment en fonction des coefficients d'autodiffusion des défauts et de leur concentration, par exemple dans le cas d'un oxyde déficitaire en oxygène,
la concentration en défaut peut elle-même se déduire de la pression partielle de dioxygène. Ainsi, il est possible d'exprimer kt en fonction des paramètres fondamentaux du matériau et de l'environnement.
Oxyde ayant une conductivité ionique prédominante
Si l'oxyde a une conductivité ionique prédominante, alors la diffusion est limitée par le transport des électrons et des trous d'électron. On a tion ≈ 1 et tel << 1, soit
- σ⋅tion⋅tel ≃ σel
et donc
Les équilibres de défauts permettent de relier la concentration en électrons à celle des trous d'électrons en fonction de la pression partielle de dioxygène. Si par exemple on suppose que le défaut prédominant est le défaut de Schottky chargés et que les trous d'électron sont prédominants sur les électrons, on a
avec donc la constante d'équilibre
-
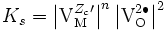
Par ailleurs, on a
avec la constante d'équilibre
-
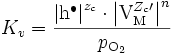
On peut ainsi exprimer le coefficient parabolique d'oxydation en fonction de Ks, Kv et de pO2 .