Alcool (chimie) - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En chimie organique, un alcool est un composé organique dont l'un des carbones (celui-ci étant tétragonal) est lié à un groupement hydroxyle (-OH). L'éthanol (ou alcool éthylique) entrant dans la composition des boissons alcoolisées est un cas particulier d'alcool, mais tous les alcools ne sont pas propres à la consommation. En particulier, le méthanol est toxique et mortel à haute dose.
Utilisation
Les alcools sont utilisés dans l'industrie chimique comme:
- solvants : l'éthanol, peu toxique, est utilisé dans les parfums et les médicaments
- combustibles : le méthanol et l'éthanol peuvent remplacer l'essence et le fioul car leur combustion ne produit pas de fumées toxiques
- réactifs : les polyuréthanes, les esters ou les alcènes peuvent être synthétisés à partir des alcools
- antigels : la basse température de solidification de certains alcools comme le méthanol et l'éthylène glycol en font de bons antigels
Classification des alcools
De manière générique, un alcool contient donc la séquence
- R - OH
où R est un radical organique variable, souvent un alkyle.
Selon la nature du carbone portant le groupement alcool, on distingue :
- Les alcools primaires, dont le carbone comportant le groupement hydroxyle est lié à au moins deux atomes d’hydrogène et un radical organique R :
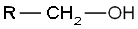
- Les alcools secondaires, dont le carbone comportant le groupement hydroxyle est lié à un atome d’hydrogène et deux radicaux organiques R et R' :
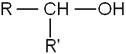
- Les alcools tertiaires, dont le carbone comportant le groupement hydroxyle est lié à trois radicaux organiques R, R' et R" :
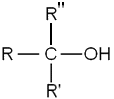
- Les phénols, sont parfois considérés comme des alcools particuliers dont le groupement hydroxyle est lié à un carbone d’un cycle benzénique. Leur réactivité étant tellement différente de celle des autres alcools (ici le carbone portant le groupement -OH n'est pas tétragonal), les phénols sont généralement classés en dehors de la famille des alcools.
- Il existe aussi un groupe considéré parfois comme un cas particulier d’alcools appelés énols. Il s’agit d’une molécule dans laquelle la fonction hydroxyle est attachée sur un carbone d'une double liaison C=C (ici encore le carbone portant le groupement -OH n'est pas tétragonal). Il s’agit en fait d'une forme tautomère d’un aldéhyde ou d’une cétone. La forme majoritaire est généralement l'aldéhyde ou la cétone, et non l'énol, sauf cas particuliers où la forme énol est stabilisé par mésomérie comme par exemple les phénols.
Production
Les alcools peuvent être produits par fermentation alcoolique, notamment le méthanol à partir du bois et l'éthanol à partir des fruits et des céréales. L'industrie n'y a recours que dans le cas de l'éthanol pour produire du combustible et des boissons. Dans les autres cas, les alcools sont synthétisés à partir des composés organiques tirés du gaz naturel ou du pétrole notamment par hydratation des alcènes.
Propriétés physico-chimiques
Aspect
Les alcools de faible masse moléculaire se présentent à température ambiante comme des liquides incolores ; les alcools plus lourds comme des solides blanchâtres.
Polarité et présence de liaisons hydrogène
Le groupe hydroxyle rend généralement la molécule d'alcool polaire. Cela est dû à sa géométrie (coudée, de type AX2E2), et aux électronégativités respectives du carbone, de l'oxygène et de l'hydrogène (Xsi(O)>Xsi(C)>Xsi(H)). Ces groupes peuvent former des liaisons hydrogène entre eux ou avec d'autres composés (ce qui explique leur solubilité dans l'eau et dans les autres alcools).
Point d'ébullition
Le point d'ébullition est élevé chez les alcools
- en raison du groupement hydroxyle qui permet les liaisons hydrogène
- en raison de la chaîne carbonée qui subit des forces de van der Waals.
Aussi, le point d'ébullition des alcools est-il d'autant plus élevé que
- le nombre de fonctions alcools est grand : un diol a une température d'ébullition supérieure à celle de l'alcool simple équivalent, qui lui-même a une température d'ébullition supérieure à l'hydrocarbure correspondant. Par exemple, parmi les alcools dérivés de l'isopropane, le glycérol (propan-1,2,3-triol) bout à 290 °C, le propylène glycol (propan-1,2-diol) à 187 °C et le propan-1-ol à 97 °C.
- la chaîne carbonée est longue : parmi les alcools linéaires, le méthanol bout à 65 °C, l'éthanol à 78 °C, le propan-1-ol à 97 °C, le butan-1-ol à 118 °C, le pentan-1-ol à 138 °C et l'hexan-1-ol à 157 °C.
- la chaîne carbonée est linéaire, par maximisation de la surface de la molécule susceptible de subir les forces de van der Waals. Par exemple, parmi les pentanols, le pentan-1-ol bout à 138 °C, le 2-méthyl-butan-1-ol à 131 °C et le 2,2-diméthyl-propan-1-ol à 102 °C.
Solubilité
La solubilité dans l'eau des alcools dépend des deux mêmes facteurs que précédemment, mais qui sont ici antagonistes :
- la chaîne carbonée, hydrophobe, tend à rendre la molécule non soluble.
- le groupement hydroxyle, hydrophile (grâce à ses liaisons hydrogènes) tend à rendre la molécule soluble
Ainsi, les alcools sont d'autant plus solubles dans l'eau que :
- la chaîne carbonée est courte : le méthanol, l'éthanol et le propan-1-ol sont solubles en toutes proportions dans l'eau, le butan-1-ol a une solubilité de 77 g⋅L-1 à 20 °C, le pentan-1-ol de 22 g⋅L-1, l'hexan-1-ol de 5 9 g⋅L-1, l'heptan-1-ol de 2 g⋅L-1 et les alcools plus lourds sont pratiquement insolubles.
- le nombre de fonctions alcools est élevé. Par exemple, les butanediols sont solubles en toutes proportions tandis que le butan-1-ol a une solubilité de 77 g⋅L-1.
- la chaîne carbonée est ramifiée : parmi les pentanols, le 2,2-diméthyl-propan-1-ol a une solubilité de 102 g⋅L-1, le 2-méthyl-butan-1-ol de 100 g⋅L-1 et le pentan-1-ol de 22 g⋅L-1.
Les alcools de faible masse moléculaire sont généralement solubles dans les solvants organiques comme l'acétone, ou l'éther.

















































