Bêta-galactosidase - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| β-galactosidase | |
|---|---|
| Caractéristiques générales | |
| Nom approuvé | β--galactoside galactohydrolase |
| Autres noms ou symbole | lactase ; β-lactosidase ; maxilact ; hydrolact ; β--lactosidase ; S 2107 ; lactozyme ; trilactase ; β--galactanase ; oryzatyme ; sumiklat |
| Fonction | glycosylase |
| Symbole | GLB1 |
| Homo sapiens | |
| Chromosome et locus | 3p21.33 |
| Autre symbole | ELNR1 |
| CAS number | |
| Entrez | 2720 |
| HUGO | 4298 |
| OMIM | 230500 |
| RefSeq | NM_000404 |
| UniProt | P16278 |
| Nomenclature EC | 3.2.1.23 |
La β-galactosidase (EC ) (parfois abrégée en béta-gal ou β-gal) est une hydrolase (EC 3) dont le rôle est d'hydrolyser des β-galactosides en monosaccharides. Ses substrats de prédilection peuvent être le ganglioside GM1, les lactosylcéramides, le lactose, ainsi que plusieurs glycoprotéines. Elle est composée de 4 sous unités semblables deux à deux.
Elle intervient dans le métabolisme du galactose et des sphingolipides, et dans la biosynthèse de glycosphingolipides.
Son absence (ou faible présence) dans l'intestin est la principale cause de l'incapacité à digérer le lactose chez l'homme, on parle d'intolérance au lactose. Génétiquement, une déficience au niveau du gène GLB1 provoque la mucopolysaccharidose de type IV (MPS4), la galactosialidose ou la gangliosidose GM1.
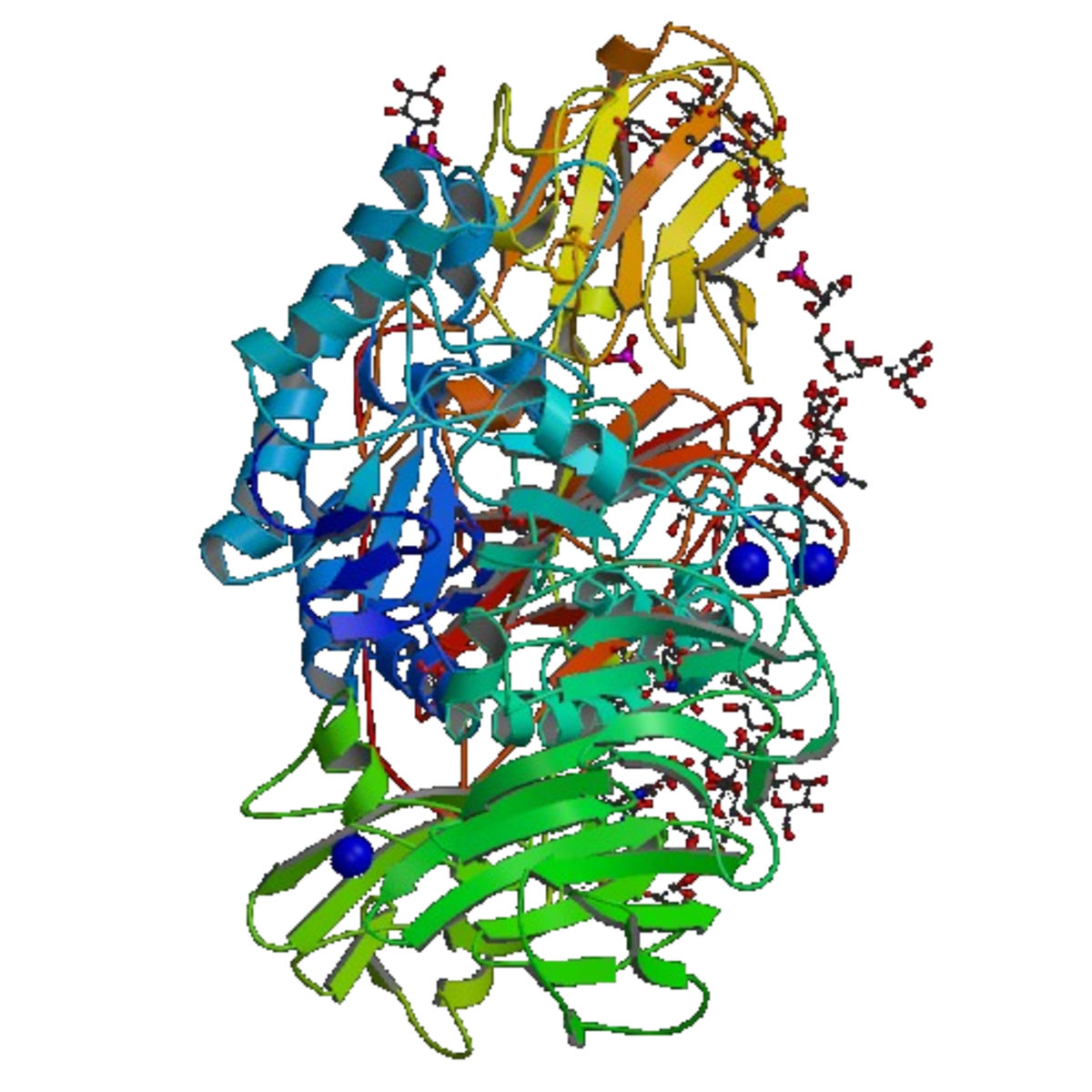
Structure
La toute première β-galactosidase à avoir été séquencée est celle d'Escherichia coli en 1970. Elle avait 1024 acides aminés. La protéine était constituée de quatre chaînes et avait un poids moléculaire de 464 kDa. Chaque unité comprenait cinq domaines, le troisième possédant le site actif. Cette enzyme peut être séparée en deux peptides, LacZα and LacZΩ, aucune de ses unités ne pouvant être active par elle-même. Cette caractéristique est utilisée dans beaucoup de vecteurs de clonage pour terminer l'α-complémentation des chaînes spécifiques artificielles d'Escherichia coli, le peptide le plus court (LacZα) étant codé par le plasmide, alors que le peptide le plus long (LacZΩ) est codé en trans par le chromosome bactérien. Lorsque les fragments d'ADN sont insérés dans le vecteur et que la production de LacZα est interrompue, la cellule n'a plus aucune activité β-galactosidase. Il s'ensuit la présence de deux types de recombinants : ceux capables de dégrader le lactose et ceux ne le pouvant pas.
En 1995, Dimri et al. proposèrent une nouvelle isoforme de la β-galactosidase possédant un maximum d'activité à pH 6.0 qui ne s'exprimerait que lors de la sénescence (l'arrêt irréversible de la croissance des cellules). Un protocole de mesure spécifique fut même développé. Aujourd'hui, on sait que cela correspond à une accumulation de β-galactosidase endogène lysosomale et son expression n'est pas utile à la sénescence. Malgré tout, cette enzyme reste un biomarqueur de prédilection pour la phase de sénescence des cellules à cause de sa facilité à être détectée.
Application en bactériologie
Cette enzyme est recherchée dans les galeries d'identification bactériennes : en l'absence de dégradation du lactose, on s'interroge sur la présence de cette enzyme, et sur la présence d'une porine, une protéine membranaire de transport des molécules.