Cinétique chimique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La cinétique chimique est l'étude de la vitesse des réactions chimiques.
Certaines réactions sont totales et très rapides voire violentes, comme les explosions. D'autres sont tellement lentes qu'elles durent plusieurs années (comme la formation de la rouille), voire plusieurs siècles (comme la formation du charbon ou du pétrole). Certaines sont même tellement lentes que les réactifs de départ sont considérés comme stables, par exemple la transformation du diamant en carbone graphite. On parle alors d'états « métastables ».
Importance et intérêt de la cinétique chimique
Importance pratique
Connaître la vitesse des réactions chimiques et être capable de la calculer est de toute première importance dans toutes les applications de la chimie.
Quelques exemples :
- La vitesse de combustion des mélanges utilisés dans les moteurs à explosion, les réacteurs d'avions, les moteurs fusées.
- La vitesse de prise des colles, des ciments, de polymérisation, de durcissement.
- La vitesse de dégradation des matériaux, d'oxydation des métaux.
- La vitesse des réactions chimiques mises en œuvre dans les usines de production de produits chimiques.
- Les vitesses d'action, de dégradation et d'élimination des médicaments (pharmaco-cinétique).
- Les vitesses de formation de transformation et d'élimination des polluants dans l'environnement.
- etc.
La maîtrise de la vitesse de réactions est fondamentale pour un bon usage des substances chimiques et éviter des catastrophes : emballement des réactions, explosions.
Intérêt théorique
La cinétique chimique permet d'établir des lois de vitesse (voir plus loin) qui servent à valider ou infirmer des hypothèses sur les mécanismes réactionnels des réactions chimiques.
Facteurs influençant la vitesse des réactions
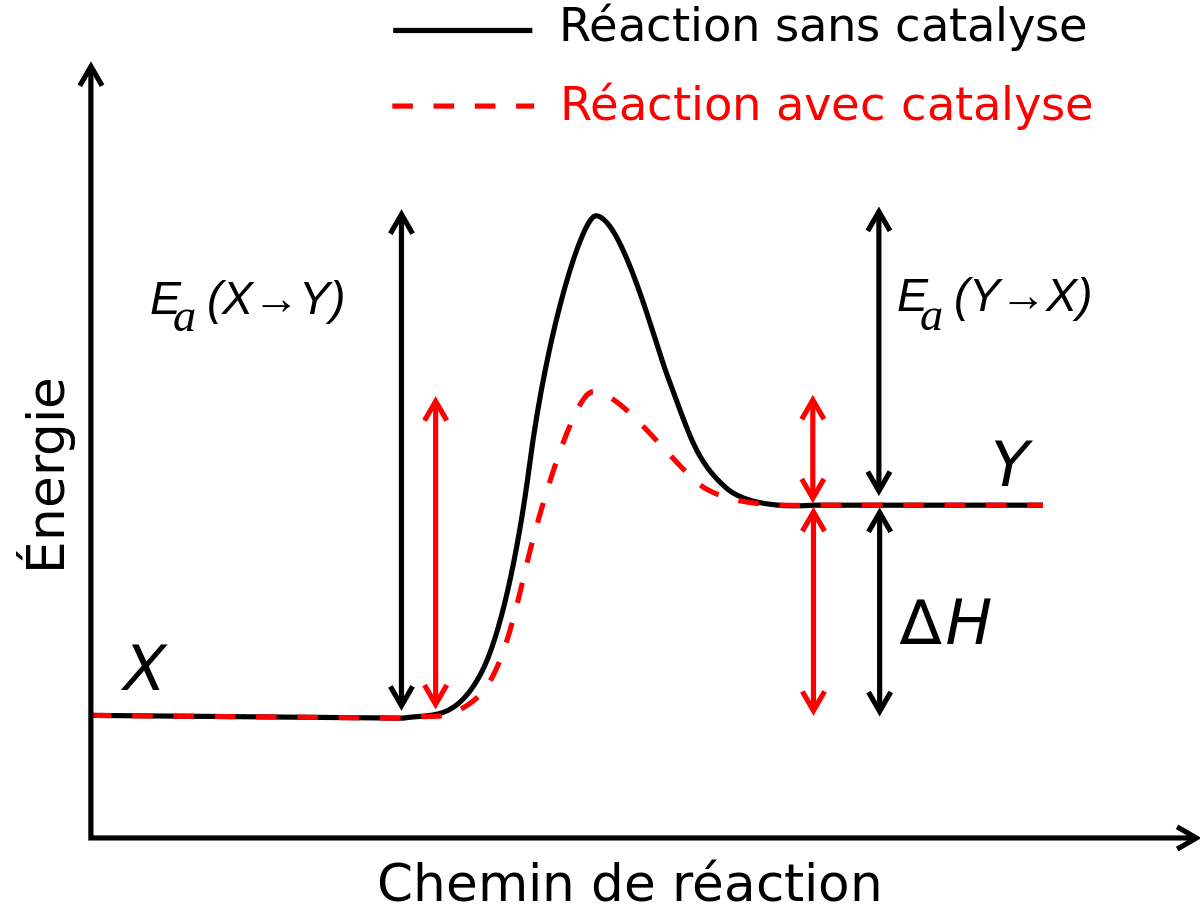
La vitesse des réactions est sous la dépendance de plusieurs facteurs. On peut citer:
- la température,
- la quantité des réactifs présents (en solution c'est la concentration des réactifs qui intervient),
- la pression pour les réactions en phase gazeuse,
- le degré de mélange des réactifs (ségrégation),
- la surface ou l'aire de contact des réactifs dans le cas de systèmes hétérogènes,
- la présence d'un catalyseur qui peut accélérer la réaction ou d'un inhibiteur qui peut la ralentir.
- la lampe UV
Le facteur le plus important est la température, car l'énergie thermique permet en effet dans de nombreux cas de franchir la barrière énergétique qui existe entre le système dans son état initial (mélange de réactifs) et son état final (produits formés).
Un autre paramètre important est l'état de la matière. De ce point de vue, les réactions les plus favorisées sont les réactions qui se déroulent au sein d'une seule phase (liquide : solution, mélange de liquides miscibles ou gazeuse). En effet, dans ces cas, les molécules des réactifs sont dans une même phase et peuvent donc facilement entrer en contact pour réagir.
Dans le cas de systèmes hétérogènes, c'est-à-dire de réactions entre:
- un solide et un gaz,
- un solide et un liquide,
- un solide et un solide,
- un liquide et un gaz,
- deux liquides non miscibles,
La réaction ne peut avoir lieu qu'aux surfaces de séparation des phases (interfaces).
Lorsque les produits sont fractionnés, la réaction est plus rapide, c'est le cas notamment des :
- aérosols (fines gouttelettes de liquide dispersées dans un gaz),
- émulsions (fines gouttelettes d'un liquide dans un autre liquide, dans le cas de liquides non miscibles),
- mélanges de poudres finement broyées (fins grains de solides),
- lysoles (poudre dans un liquide),
- mousses et écumes (bulles dans un liquide).
En effet, dans le cas de la matière fractionnée, la surface de contact entre les réactants est importante, donc les possibilités de réaction nombreuses. Pour les solides, on quantifie ceci par la surface spécifique, qui est la surface libre par unité de masse ; une poudre, un solide poreux ou une mousse (filaments imbriqués) ont une grande surface spécifique. Lorsque les réactants ne sont pas dans le même état (par exemple solide-gaz, solide-liquide, liquide-gaz), on parle de réaction hétérogène.

















































