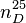Molécule d'eau - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Eau | |
|---|---|
| |
| Général | |
| No CAS | |
| No EINECS | |
| SMILES | |
| InChI | |
| Apparence | liquide transparent. Bleu sur la tranche de la glace (glacier par ex.) |
| Propriétés chimiques | |
| Formule brute | H2O |
| Masse molaire | 18,0153 ± 0,0004 g·mol-1 |
| Moment dipolaire | 1,8546 ± 0,0040 D |
| Diamètre moléculaire | 0,343 nm |
| Propriétés physiques | |
| T° fusion | 0 °C |
| T° ébullition | 100 °C |
| Masse volumique | 1,0000 g·cm-3 (3,98 °C) 0,99705 g·cm-3 (25 °C) |
| Pression de vapeur saturante | 6,11 mbar (glace, 0°C) 12 mbar (10 °C) |
| Viscosité dynamique | 0,001 Pa·s à 20 °C |
| Point critique | 373,95 °C, 22,1 MPa, 0,063 l·mol-1 |
| Point triple | 0,01 °C; 611,73 Pa |
| Conductivité thermique | 565 mW·K-1·m-1 |
| Tension superficielle à 20 °C | 0,0728 N/m |
| Conductivité électrique | 5,5×10-6 S·m-1 |
| Thermochimie | |
| ΔH0 | -241,83 kJ·mol-1 |
| ΔH0 | -285,10 kJ·mol-1 |
| ΔH° | 335 J·g-1 |
| ΔH° | 40,65 kJ·mol-1 (1 atm, 99,97 °C); 43,98 kJ·mol-1 (1 atm, 25 °C) |
| Cp | 35,22 J·mol-1·K-1 (gaz, 226,85 °C) 75,38 J·mol-1·K-1 (liquide, 24,85 °C) |
| C | 3,724 J·g-1·K-1 (gaz) |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,6206 ± 0,0020 eV (gaz) |
| Cristallographie | |
| Système cristallin | hexagonal |
| Paramètres de maille | a = 4,5212 Å c = 7,3666 Å |
| Propriétés optiques | |
| Indice de réfraction |
|
| | |
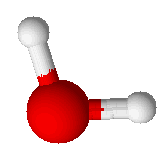
La molécule d’eau, de formule H2O, est le constituant essentiel de l’eau pure. Celle-ci contient également des ions résultant de l’autoprotolyse de l’eau selon l’équation d’équilibre : H2O = H+ + OH- (ou encore 2H2O = H3O+ + OH-). L’eau pure n’est pas présente naturellement dans la nature et doit être obtenue par des processus physiques.
Cette molécule a des propriétés complexes à cause de sa polarisation (voir le paragraphe ).
L’eau à pression ambiante (environ un bar) est gazeuse au-dessus de 100 °C, solide en dessous de 0 °C, et principalement liquide entre les deux. C’est là une particularité essentielle : les autres composés proches ou apparentés (sulfure d’hydrogène, ammoniac et méthane) sont tous gazeux même à des températures bien plus basses.
Les chimistes se réfèrent parfois (avec humour) à l’eau avec un nom savant (et justifié) comme du monoxyde de dihydrogène dans des parodies de recherche scientifique sérieuse qui présentent ce produit comme mortellement dangereux et à bannir.