Molécule d'eau - Définition
La liste des auteurs de cet article est disponible ici.
Physique
Propriétés générales
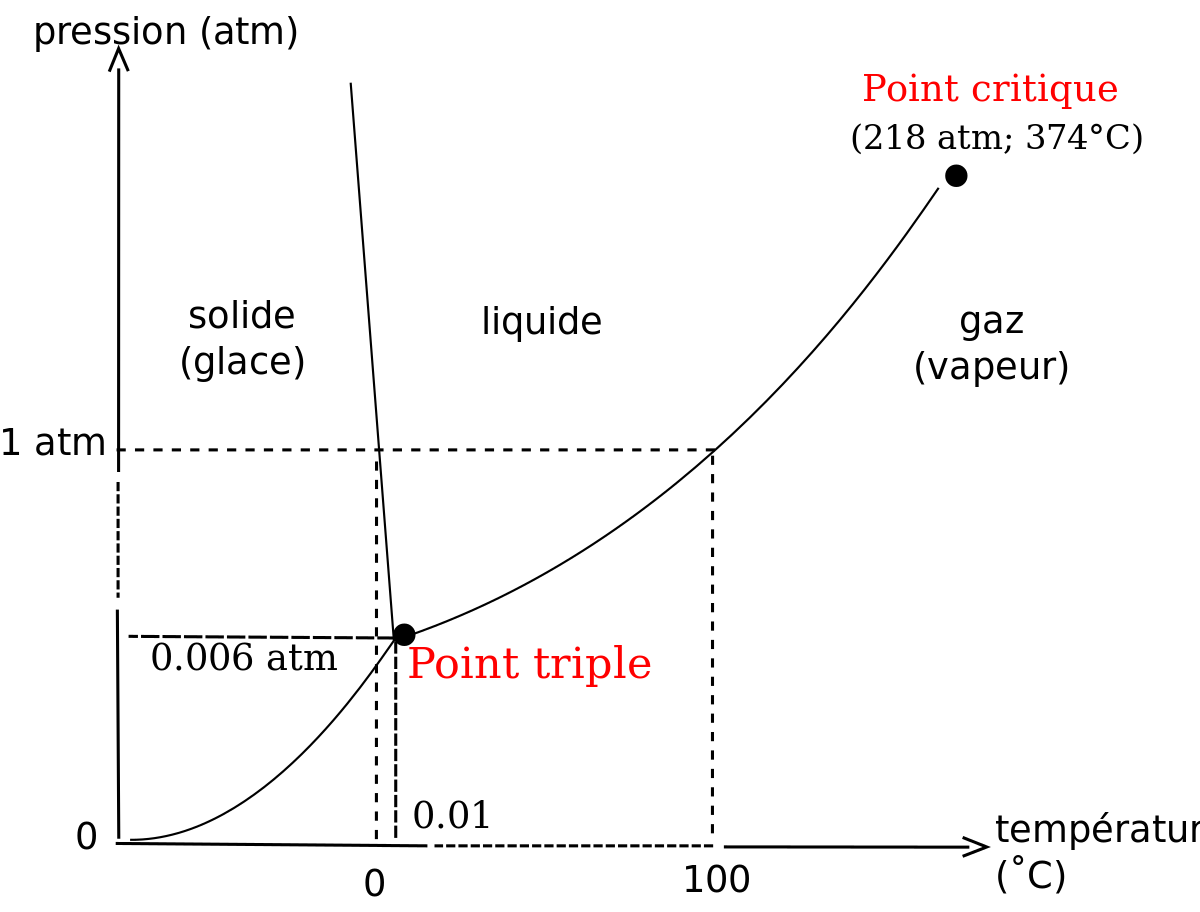
L’état solide de l’eau est la glace ; l’état gazeux est la vapeur d'eau. L’état de l’eau dépend des conditions de pression P et de température T. Il existe une situation unique (P,T) dans laquelle l’eau coexiste sous les trois formes solide, liquide, et gazeux ; cette situation est appelée « point triple de l’eau », elle a lieu à une température de 273,16 K (0,01 °C) et une pression de 611,2 Pa.
Les unités de température (degrés Celsius, kelvin) sont définies en prenant ce point triple de l’eau comme référence.
La vélocité du son dans l’eau est de 1 500 m⋅s-1 dans les conditions normales de température et de pression.
La conductivité électrique de l'eau pure à 20 °C est très faible : 5,5×10-6 S·m-1. L'eau pure est donc considérée comme un isolant électrique.
La masse d’un litre d’eau à la température de 4 °C était la première définition du kilogramme. Par approximation, on prend pour masse volumique de l’eau dans les conditions normales la valeur de 1 000 kg·m-3, une tonne par mètre cube ou encore un kilogramme par litre (1 kg·l-1).
La chaleur massique de l’eau est de 4 186 J·kg-1·K-1 dans les conditions normales de température et de pression. L’eau était utilisée comme étalon de chaleur dans d’anciens systèmes d’unité : la calorie (et la frigorie) quantifiait la chaleur à apporter pour augmenter d’un degré Celsius la température d’un gramme d’eau : soit 4,185 J.
L’eau est pratiquement considérée comme un fluide incompressible dans la plupart des applications. Son coefficient de compressibilité est de 4,5×10-10 Pa-1
| Temp. (°C) | Masse volumique (g/cm3) | Chaleur massique (J/g·K) | Viscosité (µPa·s) | Pression saturante (bar) | Enthalpie de vaporisation (kJ/kg) |
|---|---|---|---|---|---|
| 0 | 0,99984 | 4,2176 | 1793 | 0,00611 | 2500,5 |
| 10 | 0,99970 | 4,1921 | 1307 | 0,01228 | 2467,9 |
| 20 | 0,99821 | 4,1818 | 1002 | 0,02338 | 2453,4 |
| 30 | 0,99565 | 4,1784 | 797,7 | 0,04245 | 2429,6 |
| 40 | 0,99222 | 4,1785 | 653,2 | 0,07382 | 2405,9 |
| 50 | 0,98803 | 4,1806 | 547,0 | 0,12346 | 2309,9 |
| 60 | 0,98320 | 4,1843 | 466,5 | 0,19936 | 2357,7 |
| 70 | 0,97778 | 4,1895 | 404,0 | 0,31181 | 2333,1 |
| 80 | 0,97182 | 4,1963 | 354,4 | 0,47379 | 2308,2 |
| 90 | 0,96535 | 4,2050 | 314,5 | 0,70123 | 2282,7 |
| 100 | 0,95840 | 4,2159 | 281,8 | 1,01325 | 2256,6 |
| Altitude (m) | Pression (Atm) | Temp. (°C) |
|---|---|---|
| 0 | 1,00 | 100 |
| 4 810,9 (Mont Blanc) | 0,54 | 85 |
| 8 844 (Everest) | 0,32 | 72 |
| 19 200 | 0,063 | 37 |
À 20 000 m environ, l’eau entre en ébullition à la température du corps humain. C’est donc une barrière infranchissable pour l’homme sans dispositif de pressurisation (vêtement à pressurisation partielle, scaphandre, ou cabine pressurisée).
Propriétés liées à la vie terrestre
Certaines des caractéristiques de l’eau font d’elle une molécule remarquable, aux particularités qui ont permis à la vie sur Terre de se développer. Ces caractéristiques, surtout liées à sa nature dipolaire, sont explicitées dans les chapitres qui suivent.
- L’eau a une force de cohésion élevée, ce qui rend cette matière difficile à évaporer (température d’ébullition particulièrement élevée pour une molécule de cette masse molaire). Cela permet à une importante phase liquide d’exister aux températures connues sur Terre, phase liquide indispensable à la vie telle que nous la connaissons.
- De même, ses propriétés de solvant « doux » permettent à un très grand nombre de réactions biochimiques de se produire.
- Le fait que la densité de l’eau soit plus grande à l’état liquide que solide, propriété commune avec le Bismuth, a une conséquence remarquable : la glace flotte sur l’eau liquide. De surcroît, le fait que la densité de l’eau douce soit maximale à 4 °C fait que la température au fond d’un lac ne peut pas descendre en dessous de 4 °C (sauf cas extrêmes). Cela permet à la vie aquatique de survivre aux périodes glacées, car l’eau reste liquide sous son manteau de glace isolant (pour la plupart des espèces chimiques, la densité à l’état liquide est plus faible qu’à l’état solide).
- Par ailleurs, sa tension superficielle particulièrement élevée permet le phénomène de capillarité (qui permet, entre autres, à la sève des végétaux de monter) et à de nombreux êtres vivants de se déplacer sur la surface de l’eau.
Formes
- Voir la catégorie: Forme de l’eau
L’eau peut prendre beaucoup de formes. L’état solide est communément appelé glace (tandis que beaucoup d’autres formes existent ; voir l’eau amorphe) ; l’état gazeux est appelé vapeur d’eau (ou vapeur), et la phase liquide ordinaire est tout simplement appelée l’eau. Au-dessus d’une certaine température et pression critique (647 K et 22,064 MPa), les molécules d’eau entrent dans un état dit supercritique, dans lequel des agrégats moléculaires présentant des caractéristiques proches de l’eau liquide sont dans une phase de type gaz.
L’explication physique du fait que l’eau solide soit moins dense que l’eau liquide vient de la structure cristalline de la glace, connue sous le nom de glace I (h pour hexagonale). L’eau, le gallium, le bismuth, l’acide acétique, l’antimoine et le silicium sont quelques uns des matériaux qui prennent plus de place sous forme solide ; la plupart des autres matériaux se contractent. Il faut toutefois noter que toutes les formes de glace ne sont pas moins denses que l’eau liquide. Par exemple la glace HDA et la glace VHDA sont toutes les deux plus denses que l’eau liquide pure. Dans ce cas, la raison pour laquelle la forme commune de la glace est moins dense est un peu moins intuitive, elle dépend fortement des propriétés intrinsèques peu communes des liaisons hydrogène.
Indice de réfraction
| Longueur d’onde λ (nm) | T = 10 °C | T = 20 °C | T = 30 °C |
|---|---|---|---|
| 706,5 | 1,330 7 | 1,330 0 | 1,329 0 |
| 589,3 | 1,333 7 | 1,333 0 | 1,331 9 |
| 501,6 | 1,337 1 | 1,336 4 | 1,335 3 |
| 404,7 | 1,343 5 | 1,342 7 | 1,341 7 |
Tous les milieux transparents sont dispersifs, ce qui signifie que la vitesse de la lumière change avec sa longueur d’onde λ. Plus précisément, dans la partie visible du spectre électromagnétique (approximativement 400 à 700 nm) l’indice de réfraction est généralement une fonction décroissante de la longueur d’onde : la lumière bleue est plus déviée que le rouge. En outre, le taux de changement de l’indice de réfraction augmente lorsque la longueur d’onde diminue. L’indice de réfraction augmente habituellement avec la densité du milieu.
L’eau présente toutes ces caractéristiques.
Le tableau 1 montre les résultats de quelques mesures de l’indice de réfraction de l’eau par rapport à de l’air sec de même température T que l’eau et à la pression de une atmosphère (760 mmHg ou 1 013 hPa).
Pour convertir les valeurs sous forme de tableaux relatifs à l’indice du vide, ajouter 4 à la quatrième position décimale. Noter que l’indice de réfraction augmente lorsque la température de l’eau diminue. Ces résultats sont conformes aux attentes, puisque la densité de l’eau liquide augmente lorsqu’elle se refroidit. Cependant, si les mesures sont faites à de plus basses températures l’indice ne montre pas d’extremum à 4 °C, bien que la densité de l’eau y soit maximale.
L’indice de réfraction est également une fonction de la pression de l’eau, mais la dépendance est faible en raison de l’incompressibilité relative de l’eau (comme tous les liquides). En fait, sur les gammes normales des températures (0 à 30 °C), l’augmentation approximative de l’indice de réfraction est de 0,000016 quand la pression de l’eau augmente d’une atmosphère.
Les facteurs les plus significatifs affectant l’indice de réfraction sont la longueur d’onde de la lumière et la salinité de l’eau. Néanmoins, l’indice de réfraction excède de moins de 1 % la gamme indiquée des valeurs de ces variables.
- Références
- E. Dorsey, « propriétés d’Eau-Substance ordinaire », (Reinhold Publishing Corporation 1940).