Oxygène - Définition
La liste des auteurs de cet article est disponible ici.
Dans l'atmosphère terrestre
Dans des conditions normales de température et de pression, l'oxygène se présente sous la forme d'un gaz diatomique : le dioxygène, de formule chimique O2. C'est le cas de « l'oxygène » dans l'atmosphère terrestre.
La molécule d'ozone (trioxygène) est un gaz métastable qui se trouve principalement dans les hautes couches de l'atmosphère où il contribue à la filtration des ultraviolets qui frappent la Terre. Depuis les années 1970, la concentration d'ozone dans l'air au niveau du sol augmente du fait des activités humaines. L'ozone est essentiellement produit par décomposition lors de journées chaudes des oxydes d'azote issus de la combustion des carburants fossiles sous l'effet des rayons solaires ultraviolets. L'ozone est très oxydant et toxique.
Si le dioxygène représente aujourd'hui quasiment 21 % de l'air (en volume), au Carbonifère, il aurait atteint 30 %. Cette culmination de sa proportion dans l'atmosphère terrestre à cette époque est due à l'expansion massive des forêts de fougères géantes sur la Pangée, et à l'enfouissement progressif des produits organiques qui sont devenus les gisements de charbon.
L'apparition de la photosynthèse par les cyanobactéries remonte aux éons les plus anciens, et introduisit le dioxygène dans l'atmosphère de l'ordre de 1 % (à quelques %) durant le précambrien.
Il est indispensable au cycle de la vie : les végétaux photosynthétiques dégagent du dioxygène par photosynthèse alors que la respiration des animaux et des plantes en consomme. De plus, l'oxygène est un composant essentiel des molécules qui se retrouvent dans tout être vivant : acides aminés, sucres, etc.
Propriétés
L'oxygène est très électronégatif. Il forme facilement de nombreux composés ioniques avec les métaux (oxydes, hydroxydes). Il forme aussi des composés ionocovalents avec les non-métaux (exemples : le dioxyde de carbone, le trioxyde de soufre) et entre dans la composition de nombreuses classes de molécules organiques, par exemple, les alcools (R-OH), les carbonylés R-CHO ou RCO et les acides carboxyliques (R-COOH).
Énergie de dissociation des molécules diatomiques O-X à 25 °C en kJ/mol (
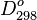
| H 429,91 | He | ||||||||||||||||
| Li 340,5 | Be 437 | B 809 | C 1 076,38 | N 631,62 | O 498,36 | F 220 | Ne | ||||||||||
| Na 270 | Mg 358,2 | Al 501,9 | Si 799,6 | P 589 | S 517,9 | Cl 267,47 | Ar | ||||||||||
| K 271,5 | Ca 383,3 | Sc 671,4 | Ti 666,5 | V 637 | Cr 461 | Mn 362 | Fe 407 | Co 397,4 | Ni 366 | Cu 287,4 | Zn 250 | Ga 374 | Ge 657,5 | As 484 | Se 429,7 | Br 237,6 | Kr 8 |
| Rb 276 | Sr 426,3 | Y 714,1 | Zr 766,1 | Nb 726,5 | Mo 502 | Tc 548 | Ru 528 | Rh 405 | Pd 238,1 | Ag 221 | Cd 236 | In 346 | Sn 528 | Sb 434 | Te 377 | I 233,4 | Xe 36,4 |
| Cs 293 | Ba 562 | * | Hf 801 | Ta 839 | W 720 | Re 627 | Os 575 | Ir 414 | Pt 418,6 | Au 223 | Hg 269 | Tl 213 | Pb 382,4 | Bi 337,2 | Po | At | Rn |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| * | La 798 | Ce 790 | Pr 740 | Nd 703 | Pm | Sm 573 | Eu 473 | Gd 715 | Tb 694 | Dy 615 | Ho 606 | Er 606 | Tm 514 | Yb 387,7 | Lu 669 | ||
| ** | Ac 794 | Th 877 | Pa 792 | U 755 | Np 731 | Pu 656,1 | Am 553 | Cm 732 | Bk 598 | Cf 498 | Es 460 | Fm 443 | Md 418 | No 268 | Lr 665 | ||

















































