Croissance bactérienne - Définition
La liste des auteurs de cet article est disponible ici.
Méthodes d'étude de la croissance
Méthodes de comptage
La façon la plus simple d'étudier la croissance bactérienne est de mesurer le nombre de bactéries à intervalles de temps réguliers dans une culture.
Détection et dénombrement direct microscopique
L'avantage est que le matériel nécessaire n'est pas très important et qu'on peut faire des colorations différentielles, des observations morphologiques et visualiser les groupements. Ce type de dénombrement permet, grâce à une coloration (Au Bleu de Méthylène ou au colorant de Newton), de différencier si on le souhaite les bactéries mortes des bactéries vivantes. L'inconvénient est que la méthode est lente, peu sensible, peu juste (peu exacte) et fatigante pour l'observateur.
- Cellule de numération (Cellule de Thoma, Cellule de Malassez, Cellule de Pétroff Hauser)
- Méthode de Breed
Comptage électronique
- Coulter : compteur de particule : on met les microorganismes en suspension dans une solution unique et on fait passer la suspension à travers un orifice à la sortie duquel il y a 2 électrodes qui se font face. Il y a une variation de la conductivité quand la cellule passe entre ces 2 électrodes. Chaque variation de conductivité est comptée comme une cellule ; toutes les cellules sont ainsi comptées. On ne distingue pas les cellules mortes des vivantes avec cette méthode.
- Cytométrie en flux : même principe que le coulter, à la différence que le comptage est effectué lorsque les cellules passent devant un faisceau laser et qu'il y a réémission de lumière fluorescente ou diffraction créant une diffusion de la lumière reçue. Méthode plutôt utilisée pour faire du tri cellulaire selon plusieurs critères.
- DEFT (Direct Epifluorescent Filter Technique) : Coloration des cellules par un fluorochrome de type acridine orangé (substance oncogène). Ce fluorochrome va se fixer entre les bases azotées des acides nucléiques cellulaires, ce qui permet d'observer sous lumière UV, (Ultraviolet), et d'avoir une fluorescence des acides nucléiques.
Les observations seront : Cellule à prédominance verte chargée en ADN (Acide DésoxyriboNucléique) ⇒ Cellule morte. Cellule à prédominance rouge chargée en ARN (Acide Ribonucléique) ⇒ Cellule vivante.
Techniques nécessitant une culture
- Techniques : Unité Formant Colonie (UFC) : on considère qu'une seule bactérie va donner une seule colonie sur un milieu de culture, on va donc compter les colonies présentes sur une culture de bactéries connaissant le volume de suspension bactérienne étalée sur le milieu ou présent dans le milieu.
- Plate count (culture sur un milieu ordinaire, sans inhibiteurs, en surface, le but étant de compter l'ensemble des bactéries capables de croître à 30 °C et qui ont été prélevées sur une surface ou dans un aliment.).
- Ensemencement en spirale en surface sur gélose en boite de Pétri.
- Technique de Postgate.
- Dénombrement en surface après culture sur membrane filtrante (pour dénombrer les bactéries d'un milieu liquide comme l'eau).
- NPP : Nombre le Plus Probable de cellules viables par tube, s'appuie sur des tables statistiques de tests de croissance.
Détermination de la Biomasse bactérienne
- Détermination de la masse sèche : on récupère la biomasse par centrifugation, ensuite on sèche à 105 °C en présence de sable de Fontainebleau jusqu'à obtenir une masse constante.
C'est une méthode rigoureuse mais elle a l'inconvénient d'exiger des suspensions bactériennes très denses et un milieu de culture sans particule. Elle ne différencie pas la biomasse morte de la biomasse vivante.
- Turbidimétrie : mesure du trouble d'une suspension bactérienne proportionnel à la biomasse présente dans la suspension. Elle ne distingue pas la biomasse morte de la vivante, mais son intérêt principal est sa rapidité et sa facilité d'application, notamment pour l'analyse dite "en ligne" c'est-à-dire en continu pour mesurer la biomasse dans un fermenteur par exemple.
- Packed Cells Volume (PCL) : méthode ressemblant un peu à la détermination de la masse sèche. On centrifuge le milieu de culture liquide pendant un temps donné, avec une accélération donnée, dans un tube de géométrie donnée, un volume de suspension cellulaire donné, et on obtient alors dans ce cas le volume du culot de centrifugation proportionnel à la biomasse bactérienne présente dans le tube.
Méthode rapide mais valable uniquement dans des conditions très standardisées.
- Mesure de l'activité cellulaire : On mesure un paramètre facilement déterminable et dont la valeur peut être corrélée avec précision à celle de la biomasse. La corrélation ne sera exacte que si l'état physiologique est constant.
On commence par une minéralisation c'est-à-dire que l'on fait passer tout l'azote présent dans les molécules organiques sous forme
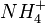
- Dosage de l'ATP (Adénosine TriPhosphate) intracellulaire : mesure d'émission lumineuse : bioluminescence, due à l'utilisation d'un substrat sur la bactérie : la luciférine.
Avantages : très bonne sensibilité, détectabilité très basse (seuil de détection : 10 − 13g d'ATP soit l'ATP contenu dans 200 Escherichia coli en phase exponentielle de croissance sur milieu cœur cervelle.) Inconvénient : la quantité d'ATP varie énormément en fonction de la souche et de l'état physiologique de la souche étudiée. Technique complètement adaptée aux mesures en phase exponentielle de croissance, aux mesures en fermenteurs, chémostats, où on a un maintien constant de l'état physiologique de la souche.
- Dosage des produits du métabolisme : corrélation entre les productions du métabolisme et la croissance bactérienne. Exemple : Acide lactique avec Lactobacillus : la croissance du Lactobacillus est proportionnelle à la production d'acide lactique.
- Mesures des variations physicochimiques du milieu biologique.
:
-
- pH (concentration en H3O + )
- rH (Potentiel d'oxydoréduction)
- Impédancemétrie
- Microcalorimétrie (production de chaleur)