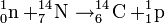Datation par le carbone 14 - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La datation par le carbone 14, dite également datation par le radiocarbone ou datation par comptage du carbone 14 résiduel, est une méthode de datation radiométrique basée sur la mesure de l'activité radiologique du carbone 14 (14C) contenu dans de la matière organique dont on souhaite connaître l'âge absolu, à savoir le temps écoulé depuis sa mort.
Le domaine d'utilisation de cette méthode correspond à des âges absolus de quelques centaines d'années jusqu'à, et au plus, 50 000 ans. L'application de cette méthode à des événements anciens, tout particulièrement lorsque leur âge dépasse 6 000 ans (préhistoriques), a permis de les dater beaucoup plus précisément qu'auparavant. Elle a ainsi apporté un progrès significatif en archéologie et en paléoanthropologie.
Historique
En 1960, Willard Frank Libby a reçu le prix Nobel de chimie pour le développement de cette méthode (cf. article sur le chercheur pour l'histoire de cette découverte).
Origine du radiocarbone naturel
Le radiocarbone naturel circule dans trois réservoirs : l'atmosphère, les océans et la biosphère.
Avec une période radioactive de 5730 ans, le radiocarbone aurait depuis longtemps disparu de la biosphère s’il n’était produit en permanence.
Dans la haute atmosphère, des réactions nucléaires initiées par le rayonnement cosmique produisent un flux de neutrons libres. Après avoir été ralentis par collision avec les molécules de l'air, les neutrons dans une certaine gamme d'énergie (cinétique) réagissent avec l'azote pour former du radiocarbone, selon l'équation bilan :
Cette réaction est privilégiée du fait que l’azote constitue 78,11 % de l’atmosphère de la Terre. C'est entre 15 000 mètres et 18 000 mètres, à des latitudes géomagnétiques élevées, que la production de radiocarbone a principalement lieu.
L'atome de radiocarbone ainsi produit réagit rapidement avec l'oxygène pour former du dioxyde de carbone.
Ce gaz circule dans toute l'atmosphère et se dissout dans les océans pour former des carbonates. Du radiocarbone circule donc aussi dans les océans.
Le dioxyde de carbone réagit également avec la biosphère. Les plantes assimilent ainsi du radiocarbone dans l'atmosphère par photosynthèse et elles sont mangées par les animaux. Les organismes marins assimilent également le radiocarbone présent dans les océans. Le radiocarbone se répand donc dans la biosphère tout au long de la chaîne alimentaire.
Le rapport 14C/C total est considéré comme uniforme dans l'atmosphère, la surface des océans et la biosphère en raison des échanges permanents entre les organismes vivants et leur milieu.
De plus, on suppose que le flux de rayons cosmiques est constant sur une longue période de temps (première approximation). Par conséquent, le taux de production du radiocarbone est constant, donc le rapport 14C/C total dans l’atmosphère, la surface des océans et la biosphère est constant (le nombre d’atomes produits égale le nombre d’atomes qui se désintègrent).
À la mort d'un organisme, tout échange avec le milieu extérieur cesse mais le radiocarbone initialement présent reste "piégé" et sa quantité se met à décroître exponentiellement selon le processus de la décroissance radioactive : ceci permet de savoir depuis combien de temps l'organisme est mort.
Principe de la datation
Le carbone 14 ou radiocarbone est un isotope radioactif du carbone dont la période radioactive (ou demi-vie) est égale à 5734 ± 40 ans selon des calculs relevant de la physique des particules datant de 1961. Cependant, pour les datations on continue par convention d'employer la valeur évaluée en 1951, de 5568 ± 30 ans.
Un organisme vivant assimile le carbone avec un fractionnement isotopique connu, de l'ordre de quelques pour-cents pour la photosynthèse. Durant sa vie, la proportion de carbone 14 (14C) présent dans l'organisme par rapport au carbone total (12C, 13C et 14C) est donc aisément rapportable à celle existant dans l'atmosphère du moment.
La datation par le carbone 14 se fonde ainsi sur la présence dans tout organisme de radiocarbone en infime proportion (de l'ordre de 10-12 pour le rapport 14C/C total). À partir de l'instant où un organisme meurt, la quantité de radiocarbone qu'il contient ainsi que son activité radiologique décroissent au cours du temps selon une loi exponentielle. Un échantillon de matière organique issu de cet organisme peut donc être daté en mesurant soit le rapport 14C/C total avec un spectromètre de masse, soit son activité X années après la mort de l'organisme.