Fonction de partition - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En physique statistique, la fonction de partition Z est une grandeur fondamentale qui englobe les propriétés statistiques d'un système à l'équilibre thermodynamique.
C'est une fonction de la température et d'autres paramètres, tels que le volume contenant un gaz par exemple. La plupart des variables thermodynamiques du système, telles que l'énergie totale, l'entropie, l'énergie libre ou la pression peuvent être exprimées avec cette fonction et ses dérivées.
Il y a en réalité plusieurs types de fonction de partition, chacune correspondant à un ensemble statistique (ou de façon équivalente, à différents types d'énergie libre). La fonction de partition canonique s'applique à un ensemble canonique dans lequel le système peut échanger de la chaleur avec son environnement à température, volume et nombre de particules fixe. La fonction de partition grand canonique s'applique à un ensemble grand canonique dans lequel le système peut échanger de la chaleur et des particules avec son environnement à température, volume et potentiel chimique fixé. D'autres types de fonction de partition peuvent être utilisés au besoin.
Fonction de partition canonique
Définition
Supposons un système thermodynamique dont le volume et le nombre de particules sont fixes qui est en contact thermique constant avec l’environnement, lequel a une température T. Ce système est appelé ensemble canonique. Étiquetons les états d’énergie exacts (les micro-états) que le système peut occuper par j=1, 2, 3, etc. et notons Ej l’énergie correspondant à chaque micro-état j. Généralement, ces micro-états sont considérés comme des états quantiques discrets du système.
La fonction de partition canonique pour une seule particule est :

où la température inverse est par convention définie par :

où kB est la constante de Boltzmann. En mécanique classique, il n’est pas vraiment correct d’exprimer la fonction de partition comme une somme discrète de termes. En effet, en mécanique classique, la position et la quantité de mouvement peuvent varier continument, et donc l’ensemble des micro-états est en réalité non dénombrable. Dans ce cas, une forme grossière de discrétisation peut être appliquée, qui revient essentiellement à traiter deux états mécaniques différents comme un seul si la différence de leur quantité de mouvement et de leur position n’est "pas trop grande".
Par exemple, la fonction de partition d’un gaz de N particules indiscernables est :
![Z={1 \over N! h^{3N}}\int{\exp[-\beta H(p_1,..,p_N,x_1,..,x_N)]d^3p_1..d^3p_N d^3x_1..d^3x_N }](https://static.techno-science.net/illustration/Definitions/autres/5/51f3f393204444982c50403003076a44_60028498c33a63ab218b03f9850e1ac2.png)
où h représente une grandeur infinitésimale exprimée en unité d'action (et prise habituellement égale à la constante de Planck pour garder la cohérence avec la mécanique quantique) et H est le hamiltonien classique du système. La raison du facteur N! sera discutée plus loin. Pour les détails, voir , parfois nommée fonction de partition configurationelle.
Par simplicité, nous utiliserons la forme discrète de la fonction de partition, mais les résultats demeurent valides pour la forme continue. En mécanique quantique la fonction partition peut être décrite formellement comme la trace d’un opérateur sur un espace d'états (elle est indépendante du choix de la base) :

où
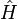
Signification et interprétation
L'importance de la fonction de partition telle que nous venons de la décrire peut ne pas sauter aux yeux. Tout d'abord, considérons ses paramètres. Elle est fonction, tout d'abord, de la température T; ensuite, des énergies E1, E2, E3,... Les énergies des micro-états sont déterminées par d'autres variables thermodynamiques, telles que le nombre de particules et le volume, aussi bien que par des quantités microscopiques comme la masse des particules le constituant. Cette dépendance à l'égard de paramètres microscopiques est le point central de la mécanique statistique.
Avec un modèle des constituants microscopiques du système, on calcule l'énergie des micro-états, et ainsi la fonction de partition, qui nous permet de remonter aux autre propriétés thermodynamiques du système. La fonction de partition peut être reliée aux propriétés thermodynamiques parce qu'elle a une signification statistique très importante. La probabilité Pj que le système occupe un micro-état j est:

C'est le célèbre facteur de Boltzmann (pour des détails sur ce résultat, voir dérivation de la fonction de partition). La fonction de partition joue alors le rôle d'une constante de normalisation (elle ne dépend pas de j) et assure que la somme des probabilités vaut 1. C'est la raison pour laquelle on appelle Z "fonction de partition" :

Elle contient la façon dont les probabilités sont réparties entre les micro-états individuels. La lettre Z est l'abréviation de l'allemand Zustandsumme (« somme sur les états »).
Calcul de l'énergie thermodynamique totale
Pour démontrer l'utilité de la fonction de partition, calculons la valeur thermodynamique de l'énergie totale. C'est tout simplement l'espérance mathématique, ou la moyenne d'ensemble de l'énergie, qui est la somme de toutes les énergies de micro-états pondérées par leur probabilité :

ou de façon équivalente :

Incidemment, on doit noter que si les énergies des micro-états dépendent d'un paramètre λ de la façon suivante :

alors la valeur de A attendue est :

Ceci nous fournit une astuce pour calculer les valeurs de nombreuses quantités microscopiques. Nous ajoutons la quantité artificiellement aux énergies des micro-états (ou en langage de la mécanique quantique à l'hamiltonien), nous calculons la nouvelle fonction et la valeur attendue, puis posons λ = 0 dans l'expression finale. Ceci est analogue à la méthode des champs sources utilisée dans la formulation des intégrales de chemin en théorie quantique des champs.
Relation avec les variables thermodynamiques
Dans cette section on établira les relations entre la fonction de partition et les divers paramètres thermodynamiques du système. Ces résultats peuvent être établis en utilisant la méthode décrite dans la section précédente et les diverses relations thermodynamiques. Comme nous l'avons vu précédemment :
- L'énergie thermodynamique est :

- La variance de l'énergie (ou fluctuation de l'énergie) est :

- La capacité calorifique est :

- L'entropie est :

- L'expression ci-dessus nous autorise à identifier l'énergie libre de Helmholtz F (définie comme F = E – TS où E est l'énergie totale et S est l'entropie) comme

Fonctions de partition de sous-systèmes
Supposons un système divisé en N sous-systèmes avec des énergies d'interaction négligeables.
Si les fonctions de partition des sous-systèmes sont


Si les sous-systèmes ont les mêmes propriétés physiques, alors leurs fonctions de partition sont égales auquel cas

Cependant il y a des exceptions bien connues à cette règle. Si les sous-systèmes sont en fait des particules identiques, au sens de la mécanique quantique, c’est-à-dire impossibles à distinguer même en principe, la fonction de partition totale doit être divisée par N!(factorielle N)

Ceci afin d'éviter de surreprésenter les micro-états. Il est nécessaire de préserver l'existence d'une limite thermodynamique pour de tels systèmes. C'est le paradoxe de Gibbs.

















































