Fulminate de mercure - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Fulminate de mercure | ||||
|---|---|---|---|---|
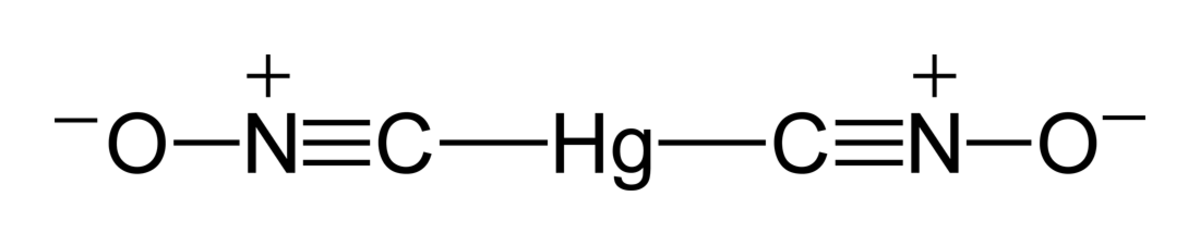
| ||||
| Général | ||||
| Nom IUPAC | ||||
| No CAS | ||||
| No EINECS | ||||
| Apparence | solide cristallin gris | |||
| Propriétés chimiques | ||||
| Formule brute | Hg(CNO)2 | |||
| Masse molaire | 284,62 ± 0,02 g·mol-1 | |||
| Propriétés physiques | ||||
| Masse volumique | 4,43 g·cm-3 | |||
| T° d’auto-inflammation | 150 °C | |||
| Précautions | ||||
| | ||||
| ||||
| Phrases R : 3, 23/24/25, 33, 50/53, | ||||
| Phrases S : 1/2, 3, 35, 45, 60, 61, | ||||
| | ||||



Danger 


Danger | ||||
| | ||||

Le fulminate de mercure (ou di-fulminate de mercure), de formule générale Hg(CNO)2, est un explosif employé dans les amorces et les détonateurs. Il est très sensible aux chocs et frottements, donc dangereux à manipuler. C'est en outre un produit très toxique et écotoxique en raison du mercure qu'il contient sous forme de nitrate de mercure, également très toxique.
Description

Il se présente sous la forme d'une poudre gris-blanchâtre insoluble dans l'eau.
son anion a un isomère ; le cyanate de mercure(II) qui, bien que de formule chimique identique, a un arrangement atomique différent et des propriétés différentes.
La structure cristalline de ce composé n'a été déterminé qu'en 2007.
Toxicologie, écotoxicologie
Comme tous les composés mercuriels, le fulminate de mercure est toxique, par inhalation et ingestion.
Suite à un contact avec la peau, le fulminate de mercure peut aussi induire
- une dermite avec éventuel érythème,
- un prurit,
- des réactions pustuleuses
- un ulcère de la peau
Après ignition ou explosion, il libère de la vapeur de mercure, également toxique, qui franchit facilement la barrière pulmonaire si cette vapeur est inhalée.
Histoire
D'abord inventé par Berthollet en 1788, le procédé est mis au point par Edward Charles Howard en 1800, il s'obtient en reprenant par l'éthanol (C2H5OH) une solution de nitrate mercurique [2(NO3)-,Hg²+] obtenue elle-même par l'action de l'acide nitrique sur le mercure.
D'abord testé et utilisé comme composant explosif, il a rapidement été utilisé comme explosif primaire de munitions, dans des capsules de cuivre ou de laiton dites « amorces », vers la fin des années 1830. Il a ainsi rapidement remplacé le silex comme un moyen de déclencher l'ignition de la poudre noire utilisée dans les cartouches d'armes à feu à chargement par la bouche.
70 ans plus tard, à la fin du XIXe siècle et dans la plupart des cas au XXe siècle, le fulminate de mercure a remplacé le chlorate de potassium dans les amorces des munitions pour fusil, pistolet et obus. Il présente un avantage important sur le chlorate de potassium : il est non-corrosif, mais tend à s'affaiblir ou à devenir instable avec le temps.
Jusqu'à la Seconde Guerre mondiale, pratiquement toutes les amorces de cartouches et de balles de fusils, de carabines et des revolvers et d'autres munitions à percussion (dont obus) étaient à base de fulminate de mercure.
En raison de sa dangerosité, et de la dépendance au mercure de sa fabrication, il est peu à peu remplacé par des composés également toxiques, mais moindrement et plus faciles à fabriquer en temps de guerre :
- l'azoture de plomb, PbN6 ;
- styphnate de plomb (trinitroresorcinate) C6HN3O8Pb ;
- dérivés de tétrazène, dont tétrazène 1(5-tetrazolyl)-4-guanyl tetrazène hydrate.




















































