Glace - Définition
La liste des auteurs de cet article est disponible ici.
Mélanges
Fusion eutectique
En hiver, les routes sont salées pour faire fondre la glace. En fait, ce n'est pas la glace qui fond, mais un eutectique glace-sel.
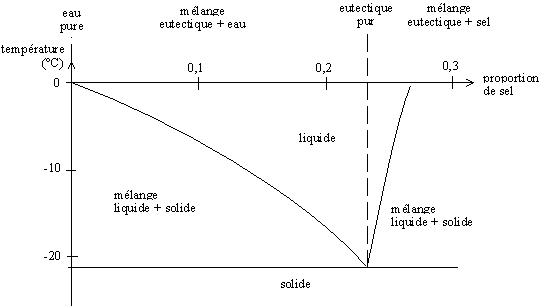
Lorsque le sel NaCl (Na+, Cl−) entre en contact avec la glace, les ions s'arrangent autour des molécules d'eau, qui sont polaires (H2δ+, Oδ−) et viennent former un composé (H2O) (NaCl) ; ce réarrangement nécessite seulement de petits mouvements des atomes, et se fait donc en phase solide. Lorsque les proportions exactes sont respectées (soit environ 22 % de sel en masse), le mélange se conduit comme un produit pur, qualifié d'« eutectique ». La température de fusion de cet eutectique H2O-NaCl est d'environ -21,6 °C.
Le diagramme de phase suivant représente la température de fusion du mélange en fonction de la proportion eau-sel.
Ainsi, pour des taux de sel inférieurs à la proportion de l'eutectique, nous obtenons un mélange eau + eutectique qui fond à une température supérieure à -21,6 °C. Pour des taux de sel supérieurs à cette proportion, nous obtenons un mélange sel + eutectique qui fond également à une plus grande température.
Le réarrangement eau + sel → eutectique ne peut se faire qu'aux points de contact entre les cristaux de glace et de sel, donc à la surface de la glace. On a donc formation d'une couche superficielle d'eutectique qui fond (si la température est supérieure à -21,6 °C) ; comme le sel est en sursaturation, il se dissout dans l'eutectique fondu, et peut réagir avec la glace qui se trouve sous la pellicule liquide. Le phénomène se propage donc, jusqu'à ce qu'il manque de l'eau ou du sel pour former un nouvel eutectique.
En théorie, il serait donc possible de prévenir la formation de glace jusqu'à -21,6 °C. Dans les faits, il est impossible de doser la quantité de sel à mettre.
Glace à température ambiante
En 2005, l'équipe coréenne de Heon Kang, de l'université de Séoul, a pu obtenir une glace d'eau à température ambiante (20 °C). Pour ce faire, un champ électrique est appliqué entre la pointe d'un microscope à effet tunnel et une surface d'or, où est disposé un film d'eau liquide, d'une épaisseur de l'ordre du nanomètre.
Dans cette expérience, l'eau se transforme en glace car les dipôles électrostatiques des molécules d'eau s'alignent sur le champ électrique. L'intensité du champ électrique à laquelle ce changement apparait (106 V·m− 1) est mille fois moins importante que ce que les modèles prédisaient.
Malgré la très faible épaisseur de la couche d'eau utilisée, ce phénomène pourrait, d'après les auteurs, intervenir au sein de nuages d'orages ou de microfissures de roches, ainsi que dans des équipements nanotechnologiques.
Laboratoire
Quelques laboratoires étudient spécifiquement la glace :
- L'Antiicing Material International Laboratory (AMIL),
- ainsi que le laboratoire de glaciologie et de géophysique de l'environnement à Grenoble.
Histoire
Les plus vieilles bâtisses que l'on connait ayant servi à conserver la glace datent d'il y a 4 000 ans et se trouvent en Mésopotamie. Ce sont des constructions en terre de forme conique inversée.
Mais on retrouve des puits à neige ou puits à glace servant à la conservation de cette denrée partout à travers le monde : Espagne, Chine, Corée, Algérie, France,... et qui sont apparus dès le XVI° siècle en ce qui concerne l'Europe. Ces grands bâtiments pouvaient conserver de la glace toute l'année afin de fournir les villes et villages les plus proches. En effet, dès la rennaissance, grâce à une période prospère tant au niveau économique que politique, des échanges interculturels entre France, Italie et Espagne ont permis la redécouverte de ce produit. La glace servait à confectionner des crèmes glacées, rafraîchir boissons et aliments, conserver les denrées, ... et même prescrite par les médecins pour calmer douleurs, fièvres, anesthésier, etc. Les "glacières" ont été exploitées jusqu'à la fin du XIX°s., c'est-à-dire jusqu'à l'apparition des usines de fabrication de glace permettant de produire la glace industriellement, au jour le jour, sans l'aléas des saisons.
Pour en savoir plus: Le Musée de la Glace (Mazaugues, Var) Le visiteur est amené à remonter le temps, de passer à travers l'ambiance d'une usine à glace de la première moitié du XXe siècle, pour aboutir à la source du produit : les glacières et les systèmes de récolte - conservation de la glace disponible dans la nature.