Hydrocarbure aromatique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un hydrocarbure aromatique ou arène est un hydrocarbure dont la structure moléculaire comprend un cycle possédant une alternance formelle de liaison simple et double, et respectant la règle de Hückel sur l'aromaticité. Le terme d'« aromatique » fut donné à ces molécules avant la découverte du phénomène physique d'aromaticité, et est dû au fait que ces molécules ont une odeur en générale douce.
La configuration aromatique de six atomes de carbone est nommée cycle benzénique, d'après le plus simple hydrocarbure aromatique possible, le benzène. Les hydrocarbures aromatiques peuvent être monocycliques ou polycycliques.
Cycle benzénique
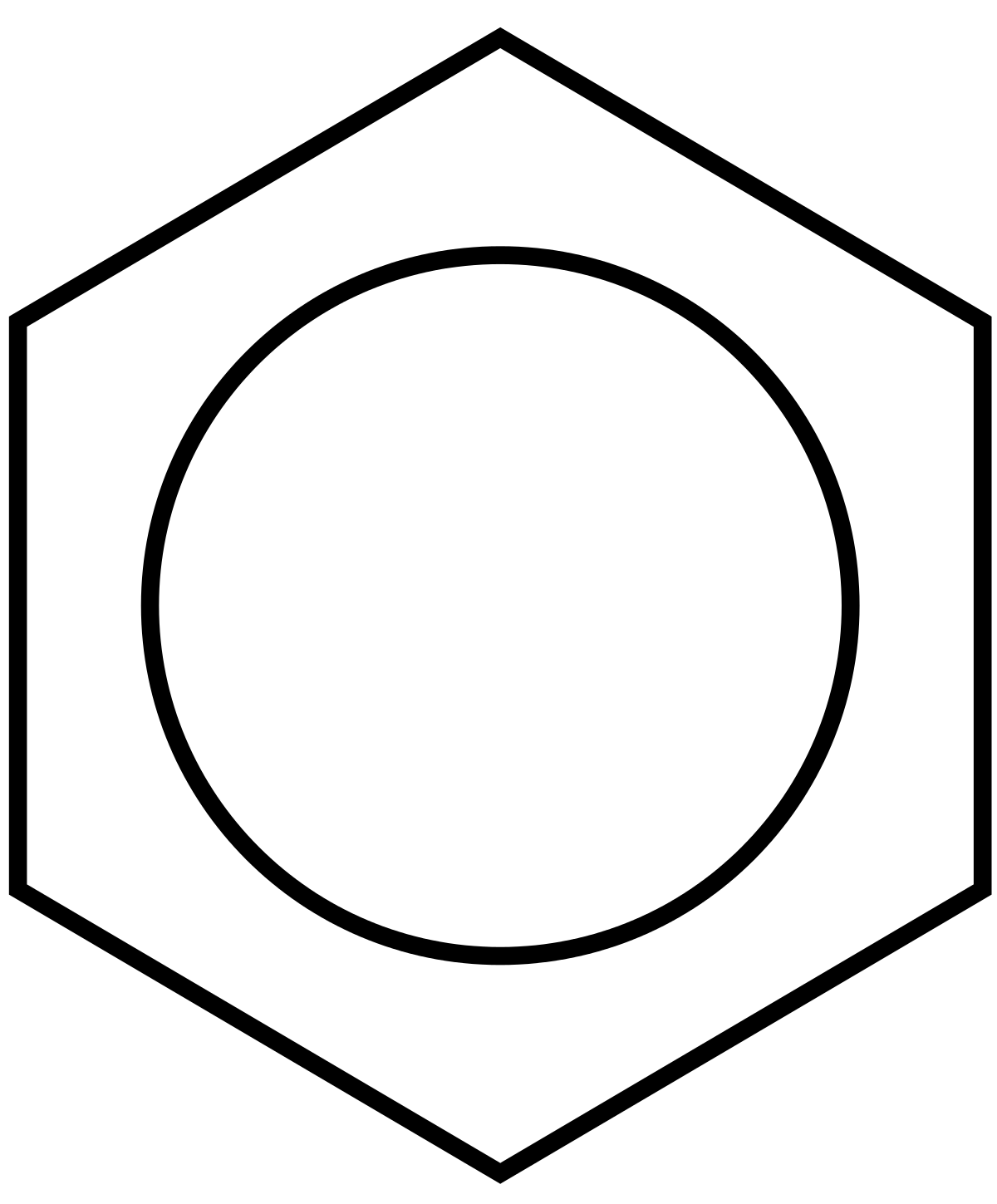
Le benzène, C6H6, est le plus simple hydrocarbure aromatique, et fut le premier considéré en tant que tel, par la nature de ses liaisons décryptée pour la première fois par Friedrich Kekulé von Stradonitz au cours du 19e siècle. Par nature, chaque atome de carbone du cycle hexagonal possède 4 électrons de valence qu'il partage avec le système. L'un d'eux est occupé par une liaison covalente avec l'électron de valence d'un atome d'hydrogène et deux autres pour la liaison covalente avec chacun des atomes de carbone voisins. Reste un électron que l'atome de carbone peut partager avec l'un des deux atomes de carbone voisins, pour former une seconde liaison (liaison π), ce qui, formellement, forme un cycle hexagonal avec une alternance de liaisons doubles et simples.
En réalité, ces liaisons π ne sont pas localisées, et les électrons π se retrouvent délocalisés sur tout le cycle, dans une orbitale moléculaire de la taille du cycle, stabilisant la molécule par aromaticité et maintenant la structure du cycle plane (contrairement par exemple au cyclohexane). Les liaisons carbone-carbone du cycle sont environ d'ordre 1,5, et leur longueur est la même partout sur le cycle (dans un système localisé, les liaisons doubles sont plus courtes que les liaisons simples). En 1925, Sir Robert Robinson a introduit, pour mieux rendre compte de cette délocalisation, une représentation en cercle du système π du cycle benzénique, représentation popularisée à partir de 1959 par le manuel de chimie organique Morrison & Boyd. L'usage propre de cette représentation est débattu, servant dans certaines publications à représenter tout système π cyclique, alors que d'autres l'utilisent uniquement pour représenter un système π cyclique aromatique obéissant à la règle de Hückel. William B. Jensen, lui, affirme qu'au regard de la proposition originale de Robinson, l'usage de la représentation par un cercle doit être limitée à des systèmes à 6 électrons π monocycliques. Dans cette optique, le symbole du cercle pour une liaison 6c–6e peut être comparé au symbole Y pour une liaison 3c-2e.
Les composés comportant un cycle benzénique partagent un certain nombre de propriétés, notamment:
- ils sont en général aromatiques (à quelques exceptions) ;
- leur ratio carbone-hydrogène est élevé ; de ce fait, ils brûlent avec une flamme jaune dégageant beaucoup de fumée ;
- la forte concentration en charge négative sur le cycle le rend nucléophile, et favorise les réactions de type substitution électrophile aromatique.
Le cycle benzénique a aussi la propriété de stabiliser les charges. Par exemple, dans le cas du phénol (C6H5-OH), lorsque le groupe hydroxyle (OH) est déprotoné, la charge négative sur l'atome d'oxygène est partiellement délocalisée sur le cycle benzénique, par mésomérie, ce qui stabilise la forme anionique, et rend de fait le proton du phénol bien plus acide (pKA=9,95) que celui d'un alcool linéaire (pKA entre 18 et 20). Cette délocalisation de la charge favorise les réactions sur le cycle, tels que les substitutions nucléophiles aromatiques et les substitutions électrophiles aromatiques.
Dérivés benzéniques
On parle de dérivé benzénique ou de dérivé du benzène pour les composés comportant un noyau central de benzène substitué par un à six groupes. Par exemple, le phénol et le toluène sont des dérivés benzéniques monosubstitués, le premier possédant un groupe hydroxyle, le second un groupe méthyle attaché au noyau benzénique. Lorsque le noyau benzénique possède plus d'un substituant leur répartition spatiale est la cible d'une nomenclature spéciale, et on répartit les composés dans les différents groupes, ortho, méta et para en fonction de la position respective de chaque groupe. Par exemple, il existe trois isomères du crésol, en fonction de la disposition des groupes hydroxyle et méthyle sur le cycle ; si les deux groupes sont voisins, il s'agit de l'isomère ortho (1,2-méthylphénol), s'ils sont séparés par un atome de carbone non substitué, il s'agit de l'isomère méta (1,3-méthylphénol) et s'ils sont opposés sur le cycle, il s'agit de l'isomère para (1,4-méthylphénol). De même, le xylénol possède deux groupes méthyles et un groupe hydroxyle, ce qui lui donne six isomères.
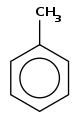
Toluène | paraxylène | |||
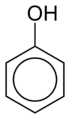
Phénol | ||||
| Acide acétylsalicylique | Trinitrotoluène (TNT) |