Hydrogène - Définition
La liste des auteurs de cet article est disponible ici.
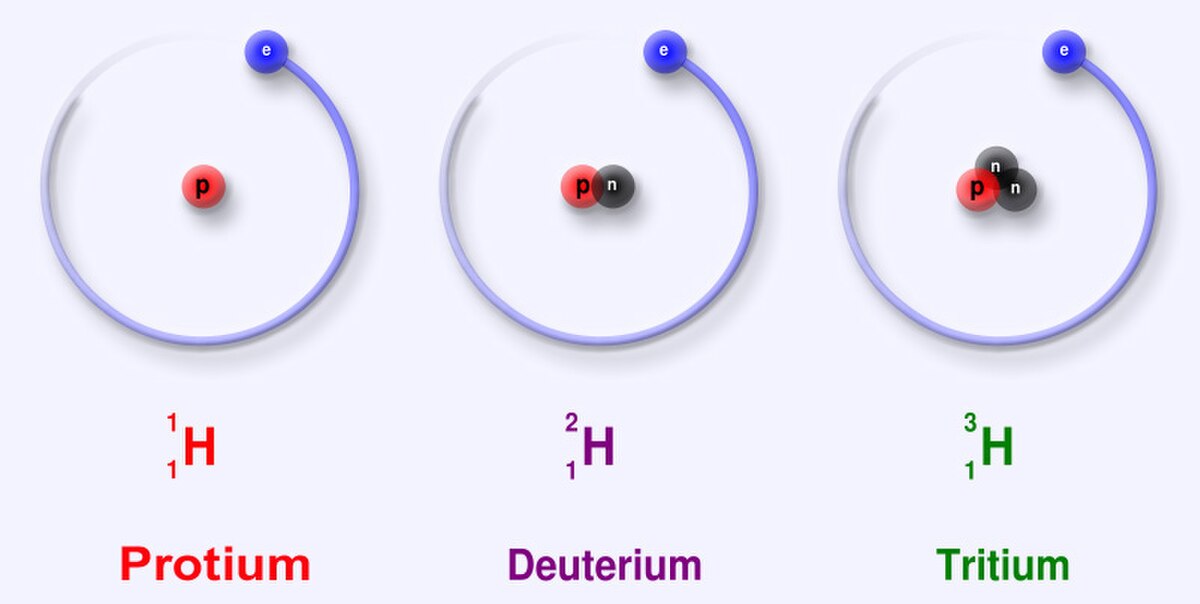
Isotopes
L’hydrogène est le seul élément dont chaque isotope porte un nom spécifique, car leur différence de masse relativement à l'hydrogène est significative : du simple au double ou au triple, ce qui explique que, contrairement à ce qui vaut pour les isotopes en général, ces différences peuvent influencer les propriétés chimiques du deutérium ou du tritium par rapport au protium (effet isotopique). L'eau lourde (DO) est par exemple toxique (à forte dose) pour de nombreuses espèces : en raison de la grande différence de masse entre les isotopes la cinétique des réactions en solution aqueuse « lourde » est considérablement ralentie…
Les isotopes connus de l'hydrogène sont :
- l’hydrogène léger ou protium (1H) ; c'est le plus abondant (~99,98 %). Simplement constitué d'un proton et ne possèdant donc pas de neutron, c'est un isotope stable.
- le deutérium (2H ou D) ; beaucoup moins abondant (~0,015 % en moyenne ; de 0,0184 à 0,0082 % de l'hydrogène naturel), il possède un proton et un neutron et c'est un isotope stable. Présent essentiellement (sur Terre) sous forme d'eau deutérée HDO (eau demi-lourde).
- le tritium (3H ou T) ; Constitué d’un proton et de deux neutrons, il n'est présent qu'en infime quantité (un atome de tritium pour 1018 atomes d’hydrogène). Instable, c'est le seul isotope radioactif de l’hydrogène, dont il possède semble-t-il les mêmes propriétés chimiques et physiques si ce n'est qu'il se transforme en 3He par émission d'un électron (radioactivité β−). 2H et 3H peuvent participer à des réactions de fusion nucléaire…
Sa radiotoxicité est réputée très faible lorsqu'il est présent sous forme HTO (eau tritiée), elle est moins connue et à ce jour moins bien comprise lorsqu'elle est émise par une forme organique (les études présentent des résultats contradictoires ou très variables selon leurs protocoles expérimentaux). Dans l’environnement, le tritium peut prendre la place de l’hydrogène dans toutes les molécules où il est présent, y compris dans les molécules « biologiques » et jusque dans l'ADN où il peut être cause de cassure de l'ADN, de mutations ou d'apoptoses cellulaires. Le tritium est un élément rare ce qui explique une concentration de l'eau ou des tissus généralement très faible (hors contaminations accidentelles liées à une source anthropique de tritium). - le quaternium ou le tétradium (4H ou Q) est l'isotope le plus instable de l'hydrogène, à émission de neutron. Sa demi-vie est ultracourte : 1,39 × 10−22 secondes.
- l'hydrogène 7, l'isotope le plus riche en neutrons jamais observé. Sa demi-vie est de l'ordre de 10−21 secondes.
Composés chimiques de l'hydrogène
Les composés covalents
L'atome d'hydrogène peut engager son unique électron pour former une liaison covalente avec de nombreux atomes non-métalliques.
Les composés les plus connus sont :
- la molécule de dihydrogène H ;
- la molécule d'eau HO ;
- les molécules d'hydrocarbures CH.
L'hydrogène est également présent dans toutes les molécules organiques, où il est lié principalement à des atomes de carbone, d'oxygène et d'azote.
L'ion hydrogène H+ ou proton
L'atome d'hydrogène peut perdre son unique électron pour donner l'ion hydrogène H+.
On le désigne alors couramment par le nom de proton, étant donné qu'en perdant son électron l'atome est réduit à son noyau, et que dans le cas de l'isotope le plus abondant 1H ce noyau n'est constitué que d'un proton. Cette appellation n'est pas rigoureusement correcte si l'on tient compte de la présence, certes discrète (inférieure à 0,02 %), des autres isotopes…
Son rayon est très petit : environ 1,5×10−15 m contre 5×10−11 m pour l'atome.
Il n'existe pas à l'état libre mais est toujours lié au nuage électronique d'une molécule. En solution aqueuse (telle HO) il est solvaté par des molécules d'eau ; on peut en simplifiant considérer qu'il est capté par une molécule d'eau, formant un ion oxonium HO+.
Les hydrures
L'hydrogène se combine avec la plupart des autres éléments car il possède une électronégativité moyenne (2,2) et peut ainsi former des composés avec des éléments métalliques ou non-métalliques. Les composés qu'il forme avec les métaux sont appelés hydrures dans lesquels il se trouve sous forme d'ions H− qui parfois n'existent qu'en solution. Dans les composés avec les non-métalliques, l'hydrogène forme des liaisons covalentes, car l'ion H+, qui n'est rien d'autre qu'un simple proton, a une trop forte tendance à s'associer avec les électrons. Dans les acides en solution aqueuse, il se forme des ions HO+, association du proton et d'une molécule d'eau.
Les réactions acido-basiques
L'hydrogène joue un rôle primordial dans une réaction acido-basique (au sens de la théorie de Bronsted-Lowry) puisque cette dernière correspond formellement à l'échange d'un ion hydrogène H+ entre deux espèces, la première (l'acide) libérant H+ par rupture d'une liaison covalente, et la deuxième (la base) captant cet H+ par formation d'une nouvelle liaison covalente :
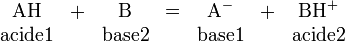
La liaison hydrogène
La liaison hydrogène est une interaction électrostatique entre l'hydrogène lié chimiquement à un atome électronégatif A et un autre atome électronégatif B (A et B étant typiquement O, N ou F en chimie organique).
Cette liaison joue un rôle important en chimie organique, puisque les atomes d'oxygène O, d'azote N ou de fluor F sont susceptibles de créer des liaisons hydrogène, mais aussi en chimie inorganique, entre les alcools et les alkoxydes métalliques.