Eau lourde - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Eau lourde | |
|---|---|
| |
| Général | |
| Synonymes | oxyde de deuterium |
| No CAS | |
| No EINECS | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
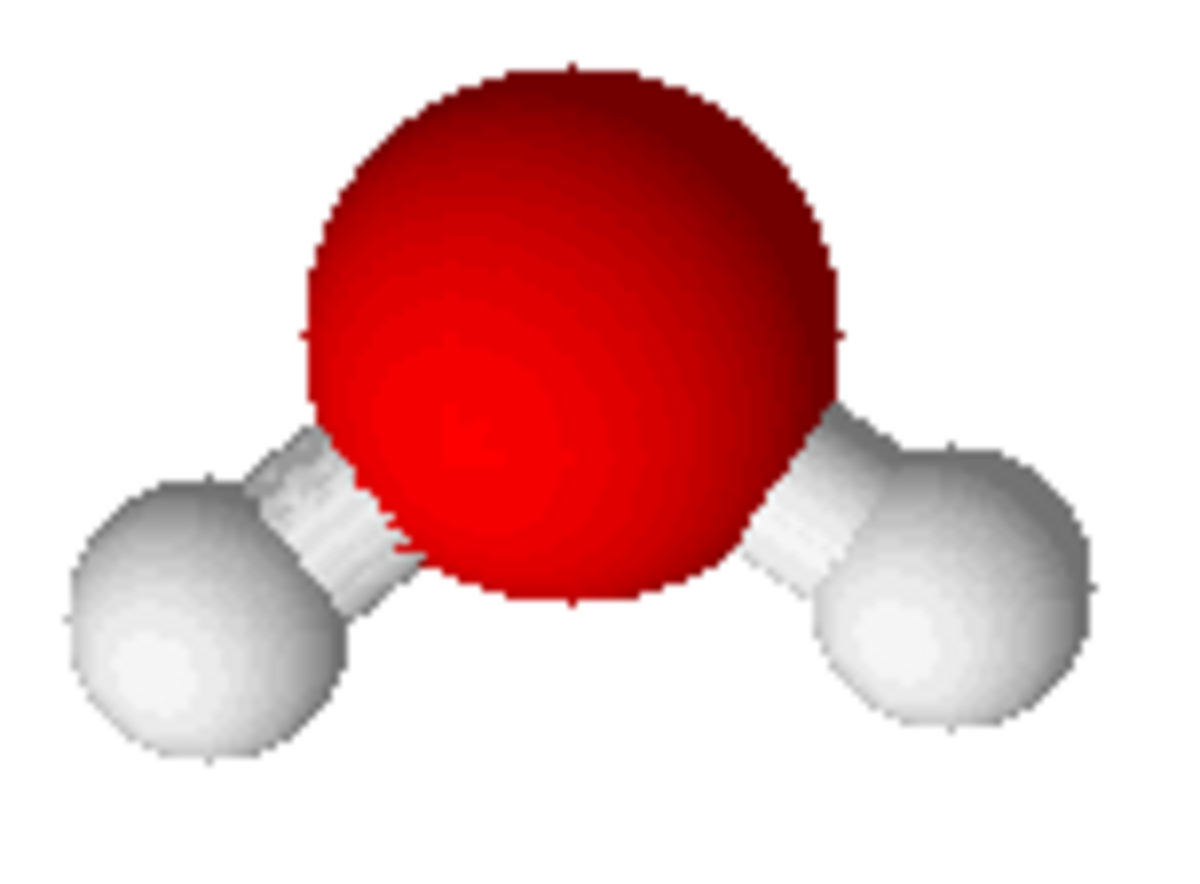
| Formule brute | ²H2O |
| Masse molaire | 20,0276 ± 0,0003 g·mol-1 |
| Moment dipolaire | 1,84 D |
| Propriétés physiques | |
| T° fusion | 3,81 °C |
| T° ébullition | 101,4 °C |
| Masse volumique | 1,10448 g·cm-3 (25 °C) |
| Pression de vapeur saturante | 2,740 kPa (25 °C) |
| Point critique | 370,74 °C 21,941 MPa 56,3 cm3·mol-1 |
| Propriétés optiques | |
| Indice de réfraction |
|
| | |
L'eau lourde est de l’oxyde de deutérium (formule : D2O ou ²H2O). Chimiquement, elle est identique à l’eau normale (H2O), mais les atomes d’hydrogène dont elle est composée en sont des isotopes lourds, du deutérium, dont le noyau contient un neutron en plus du proton présent dans chaque atome d’hydrogène.
Il existe aussi de l’eau semi-lourde (HDO ou H²HO), d'ailleurs en proportion naturelle bien plus importante que l'eau lourde.
Gilbert Newton Lewis isola en 1933 le premier échantillon d’eau lourde pure.
Propriétés physico-chimiques de l'eau lourde comparées à celles de l'eau (H2O)
| Propriété | D2O (eau lourde) | H2O (eau) |
|---|---|---|
| Température de fusion (°C) | 3,81 | 0,00 |
| Température de vaporisation (°C) | 101,42 | 100,00 |
| Densité (à 20 °C) | 1,1056 | 0,9982 |
| Température correspondant à la densité la plus élevée (°C) | 11,6 | 4,0 |
| Viscosité (à 20 °C, Pa·s) | 1,25.10-3 | 1,005.10-3 |
| Tension superficielle (à 25 °C, N·m-1) | 7,193·10-2 | 7,197·10-2 |
| Enthalpie de formation (gaz, kJ/mol) | -249,20 | -241,83 |
| pH (à 25 °C) | 7.41 appelé aussi pD | 7.00 |
Sa densité est plus élevée que celle de l'eau, d'où son nom d'eau « lourde ».
Considérations médicales
L’eau lourde n’est pas considérée comme toxique. Cependant quelques réactions métaboliques nécessitent de l’eau classique, c’est pourquoi la consommation exclusive d’eau lourde peut être considérée comme dangereuse pour la santé.
Des expériences sur des souris ont montré que le principal effet de cette consommation est de réduire le nombre de mitoses, causant progressivement la dégradation des tissus qui nécessitent une rapide régénération. Après plusieurs jours d’ingestion d’eau lourde uniquement, les fluides corporels contiennent environ 50 % d’eau lourde. À ce moment, les symptômes commencent à apparaître, dont la réduction des divisions cellulaires, notamment pour les cellules à renouvellement rapide telles que celles des cheveux ou des parois de l’estomac.
Utilisations
Résonance magnétique nucléaire
L’oxyde de deutérium est utilisé en spectroscopie par résonance magnétique nucléaire aussi appelée RMN.
Modérateur de neutrons
L’eau lourde est utilisée dans certaines filières de réacteurs nucléaires comme modérateur de neutrons dans le but de ralentir les neutrons issus de réactions de fission nucléaire. Les neutrons ralentis ont alors une probabilité plus élevée d'aller provoquer de nouvelles fissions de noyaux d'uranium, permettant ainsi la réaction en chaîne.
Le réacteur CANDU est un réacteur nucléaire à uranium naturel à eau pressurisée utilisant ce système de modération.
L’eau (classique H2O) est aussi capable de ralentir les neutrons d’une réaction de fission. Cependant elle les absorbe trop pour que la réaction puisse s’entretenir d’elle-même dans un réacteur à uranium naturel. Toutefois, cette eau normale peut être utilisée si de l’uranium enrichi est utilisé.
Détecteur de neutrinos
L’observatoire de neutrinos de Sudbury SNO (Ontario, Canada) utilise 1 000 tonnes d’eau lourde dans une cuve enterrée dans une mine à plus de deux kilomètres sous terre afin d’être protégé des rayons cosmiques. Le SNO détecte l’Effet Tcherenkov produit quand un neutrino traverse l’eau lourde.