Masse - Définition
La liste des auteurs de cet article est disponible ici.
Masse et quantité de matière
Le Système international d'unités, continuellement amélioré depuis le XXe siècle, établit une distinction fondamentale entre la quantité de matière, mesurée en mole, et la masse, mesurée en kilogramme.
La masse d'un corps est définie, par Newton, comme une mesure de la quantité de matière de ce corps. Vers 1785, Antoine Lavoisier mis en évidence la loi de conservation de la masse d'un système fermé « quelles que soient les transformations physicochimiques dont il peut être le siège ». Cette loi, qui se révéla approximative, confirmait la définition de la masse et permit de s'en servir comme constante dans les transformations chimiques (d'où la classification des éléments chimiques en fonction de leur masse atomique dans le tableau de Mendeleiev) et fut un élément de mesure permettant, entre autres, de mettre en évidence l'existence des atomes.
La relativité restreinte et la physique atomique révèlent que masse et quantité de matière sont deux quantités qui ne sont pas exactement proportionnelles (donc que la masse n'est pas extensive) ; bien que pour une substance inerte donnée (le carbone par exemple), la masse est directement proportionnelle à la quantité de matière : dix grammes de carbone contiennent bel et bien dix fois plus de matière qu'un seul gramme de carbone.
Exemple de distinction
Une mole d'atomes de carbone 12 et trois moles d'atomes d'hélium 4 contiennent le même nombre de protons, de neutrons et d'électrons, soit 6 moles de protons, 6 moles de neutrons et 6 moles d'électrons. Or il se trouve que la masse d'une mole de carbone 12 vaut exactement 12 grammes (par définition même du nombre d'Avogadro) alors que la masse de trois moles d'hélium 4 vaut 3 x 4,0026 = 12,0078 grammes. Cela revient à dire qu'à l'échelle atomique, un atome de carbone 12 a une masse légèrement inférieure à celle de trois atomes d'Hélium 4, bien que l'on ait affaire dans un cas comme dans l'autre à 6 protons, 6 neutrons et 6 électrons. Puisque des quantités parfaitement identiques de protons, de neutrons et d'électrons peuvent avoir des masses différentes selon le type d'atome auquel ils appartiennent, il s'ensuit qu'on ne peut pas assimiler tout simplement la masse à la quantité de matière.
Dans cet exemple, la différence de masse observée s'explique par la différence entre les énergies de liaison nucléaire de l'hélium et du carbone : si la masse est comprise comme une forme de l'énergie contenue dans la matière, on conçoit que des liaisons atomiques différentes utilisent des quantités différentes d'énergie et en laissent plus ou moins sous la forme de masse. Que la masse soit considérée comme une forme de l'énergie contenue dans la matière, vient de la fameuse formule
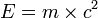
Mesure de la masse
La mesure de la masse s'appelle le pesage, bien que ce terme provienne du mot « poids ».
La seule manière de mesurer directement une masse consiste à la comparer à une autre masse ; c'est le principe des balances.
On peut aussi estimer la masse à partir du poids, c'est-à-dire que l'on mesure la force qu'exerce l'objet à peser ; le dispositif est en fait un dynamomètre. C'est le cas le plus courant des pèse-personne et des balances électroniques.
On peut aussi estimer une masse par la perturbation du champ de gravité qu'elle induit. Cette mesure par gravimétrie n'est utilisable que pour les objets extrêmement lourds et est utilisée en géologie pour estimer la taille d'une formation rocheuse, ainsi qu'en archéologie.
- Remarques
Il faut se rappeler que la livre, en France, n'avait pas la même valeur sur tout le territoire : la provençale, la parisienne ou encore la bretonne n'avaient pas tout à fait la même valeur et aujourd'hui encore, la livre tout comme le gallon n'ont pas la même valeur aux États-Unis et au Royaume-Uni
Beaucoup de marchandises se vendaient au volume, par boisseaux ou encore par barils, soit 18 boisseaux (235 litres) — différent du baril pétrolier qui ne fait que 158,98 litres.
Dans l'Union européenne, de nombreuses masses (et volumes) sur les produits de consommation sont indiquées en quantité estimée. Ils sont marqués comme tel, d'un « e » minuscule.
Le kilogramme est l'unité de masse et non de poids.

















































