Transmission des caractères acquis - Définition
La liste des auteurs de cet article est disponible ici.
Découvertes récentes et mécanismes proposés
Depuis les travaux de Paul Kammerer, que l'on a considéré comme falsifiés suite à la découverte d'une fraude tardive et à son suicide, et la théorie synthétique de l'évolution, l'étude de la transmission des caractères acquis a été un sujet longtemps délaissé, voire tabou, pour les biologistes.
Néanmoins, en 2002, des chercheurs (Marcus Pembrey, professeur de génétique clinique de l'Institute of Child Health à Londres, en collaboration avec le chercheur suédois Bygren Lars Olov) ont montré, grâce à des analyses de généalogie sur des suédois, que leur vie est influencée par le mode de vie de leurs grands-parents. Ainsi des grands-parents ayant connu la famine à des moments critiques de leur vie peuvent influencer l’espérance de vie de leurs petits enfants en augmentant le risque de développer des maladies cardio-vasculaires ou un diabète.
Jusqu'à récemment, ont considérait que la mère transmet de l'ADN à l'embryon pendant les premières phases de sa segmentation puis ses anticorps au cours du développement fœtal, l'influence de la mère s'arrêtant avec la fin de l'allaitement. Plusieurs mécanismes épigénétiques ont été mis en évidence depuis.
Une transmission héréditaire de caractères sans lien direct avec la séquence nucléotidique a été montré.. Elle concerne notamment :
- l'état de méthylation de l'ADN :
Certaines bases de l’ADN peuvent être méthylées (cytosine précédée d’une guanine) ces méthylations permettent d’inactiver ou d’activer la mise en place de l’ARN polymérase sur le promoteur et empêche donc la transcription.
- l'état de compaction de la chromatine :
La chromatine est l'association des molécules d'ADN avec des protéines histones. Selon son degré de condensation, l'ADN est ou n'est pas accessible aux facteurs de transcription. L’acétylation de la lysine terminale des histones induit un relâchement de la chromatine. La méthylation de la lysine et de l'arginine joue aussi un rôle dans la régulation de la transcription.
Par ailleurs, deux autres mécanismes ont été étudiés.
- La paramutation :
C’est une interaction entre deux allèles d’un unique locus où l’un a subi une modification épigénétique. On obtient alors un changement héréditaire du phénotype. Ce changement est considéré comme une exception aux lois de Mendel.
- la rétrotranscription au sein de spermatozoïdes
Mémoire du stress chez les plantes
Une étude remarquable parue en 2006 dans Nature a montré que les plantes font parfois face aux différents stress environnementaux (température, humidité, disponibilité des nutriment du sol ou infection virale par exemple) en déstabilisant leur génome au travers d’une augmentation du taux de recombinaison homologue dans les tissus somatiques, et que cette réponse, qui implique une adaptabilité accrue, pouvait être transmise aux générations suivantes.. Un facteur élevé a été attribué à cette étude par la Faculty of 1000 biology
Des plantes transgéniques du genre Arabidopsis ont été utilisées pour mettre en évidence ce phénomène. La nouvelle séquence implantée dans ces plantes comporte deux séquences chevauchantes (GU et US) du gène β-glucuronidase (GUS), séparées par un gène de résistance à l’hygromycine (antibiotique). Une recombinaison homologue entre les deux fragments produit un gène β-glucuronidase fonctionnel (GUS), détectable par coloration histochimique. Ici, le stress était induit par une exposition à des rayons UV-C (longueur d’onde 280-10 nm) qui augmentent entre 2 et 4 fois la fréquence de recombinaison homologue des tissus somatiques (des résultats similaires peuvent être obtenus par l’injection dans la plante de peptides issus d’un pathogène qui imite son attaque).
La fréquence de recombinaisons resta haute dans les 4 générations suivantes (autofécondation), suggérant que la mémoire de stress serait un phénomène basé sur un mécanisme épigénétique plutôt que génétique. Une série de croisements entre individus, transgéniques ou non et stressé ou non, montra que les descendants peuvent hériter de cette mémoire par un seul des parents (mâle ou femelle) et que l’information épigénétique présente sur un chromosome peut influencer l’autre (le croisement entre plante transgénique non stressée et plante non transgénique stressée donna un descendant avec un gène β-glucuronidase fonctionnel)
Les mécanismes dirigeant ce processus sont inconnus mais il est possible que l’organisation de la chromatine joue un rôle dans la régulation de la recombinaison homologue, et ce processus pourrait s’apparenter à un phénomène de paramutation..
Paramatutation
paramutation chez la souris
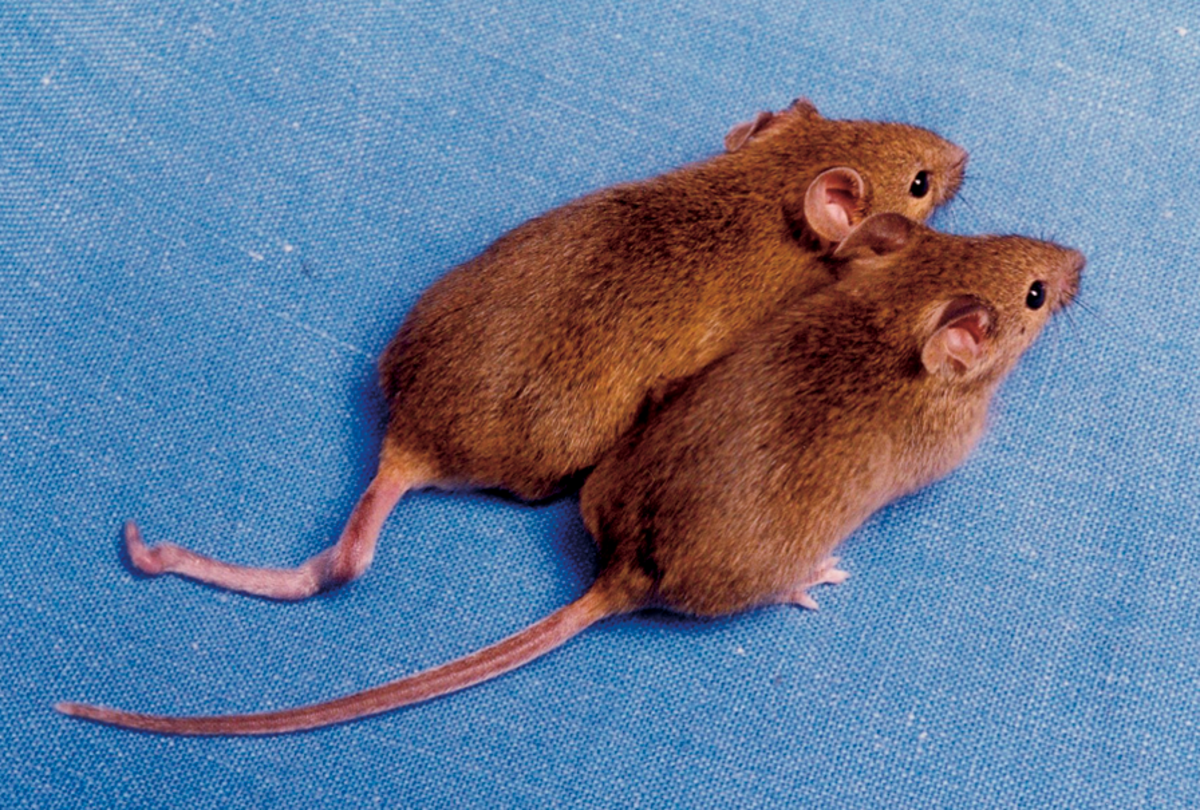
Un article paru en 2006 dans Nature met en évidence l'existence de paramutation chez la souris.
Kit est un gène de souris codant pour une tyrosine kinase et impliqué dans l'hématopoïèse, dans la différenciation des cellules germinales et dans la mélanogénèse. Des souris hétérozygotes (génération 1), possédant l'allèle sauvage Kit et l'allèle Kit(tm1alf) (créé par l'insertion de Lac-Z juste en aval du site d'initiation de la traduction), sont viables et possèdent le phénotype visible et caractéristique "bout de queue blanche" tandis que les souris homozygotes Kit(tm1alf) meurent.
Tous les descendants issus du croisement (génération 2) entre ces souris hétérozygotes et des souris homozygotes pour l'allèle sauvage Kit sont de phénotype "bout de queue blanche". Ceci est contraire aux lois de Mendel qui prédirait les proportions suivantes chez les descendants : la moitié de phénotypes sauvages et la moitié de phénotypes "bout de queue blanche". Ces résultats s'expliquent par le phénomène de paramutation : l'allèle Kit (tm1alf) dit "paramutagène" induit un changement de l'allèle Kit dit "paramutable".
De plus, les croisements entre ces mêmes descendants et d'autres souris homozygotes pour l'allèle Kit donnent également naissance à des souris (génération 3) de phénotype "bout de queue blanche". On en conclut que l'allèle paramutable Kit est devenu paramutagène chez les souris de la génération 2, on parle donc d'allèle Kit*.
L'allèle Kit* a un taux de transcription plus élevé. Mais de nombreux transcrits issus de cette transcription sont aberrants. Et ces mêmes transcrits aberrants sont retrouvés en grande quantité dans le sperme de la souris et pourraient être à l'origine de la paramutation de l'allèle Kit sauvage dans le zygote. Conclusion : dans cette expérience, ce seraient les transcrits qui seraient responsables de la (para)mutation.
paramutation chez le maïs
Les ARN peuvent être à la base d’un changement de chromatine qui induira une paramutation. Le gène b1 code un facteur de transcription qui régule la pigmentation des tissus en intervenant dans la synthèse de l’anthocyanine. BI et B’ sont deux allèles de ce gène. L’allèle BI est paramutable et a un fort taux d’expression tandis que l’allèle B’ est paramutagène et s’exprime faiblement. Les allèles qui sont impliqués dans la paramutation de ce gène possèdent une séquence de 853 paires de bases (pb) qui est répétée sept fois et située 100 kilo bases (Kb) en amont du site d’initiation de la traduction. Il a été observé que le faible taux d’expression de l’allèle B’ était dû au fait que les sept exemplaires de la séquence répétée étaient plus méthylés et que la chromatine était plus compacte par rapport à l’allèle BI.
Mais on ne connaît pas les mécanismes d’action de ces sept séquences sur l’expression du gène b1. Pour savoir quel type d’interaction existe entre les deux allèles impliqués dans la paramutation, les recherches se sont tournées vers le gène Mop1 qui code pour une ARN polymérase. En effet, il semblerait que cet ARN polymérase ait pour rôle de fabriquer des ARNsi résultant de la transcription de la séquence répétée sept fois 100 Kb en amont du gène b1. On pense donc que ces ARNsi sont responsables de la paramutation via des mécanismes complexes encore méconnus.
Pour explorer encore plus profondément cette question, il faudrait comprendre pourquoi lorsqu’il n’y a qu’une séquence répétée en amont d’un allèle neutre (ni paramutagène, ni paramutable), le taux d’ARNsi est le même que quand cette séquence est répétée sept fois. Il faudrait également voir si le fait que le gène Mop1 soit pléïotrope (Mop1 agit également au niveau de la floraison, de la santé et de la taille de la plante) influe sur le phénomène de paramutation.
Rétrotranscription dans les cellules germinales
Depuis les années 1970, les études sur les cellules germinales mâles et la transcriptase inverse (RT) ont montré que les spermatozoïdes matures sont un lieu d’intense expression de gènes codant pour la transcriptase inverse (rétrotransposons) et que ces cellules ont la capacité d’ « absorber » de l’ADN ou de l’ARN étranger présent dans le milieu. Ainsi, ces mécanismes pourraient permettre aux spermatozoïdes de produire des rétrogènes (rétrotransposons ne codant pas pour la RT) biologiquement actifs.
Ces découvertes remettent en cause la séparation entre les cellules germinales et le soma admise depuis les travaux de Weismann. On considère classiquement que les cellules germinales sont garantes de la transmission « honnête » de l’information génétique spécifique à un individu jusqu’à sa descendance. Une telle conception n'est pas entièrement invalidée puisque ces cellules comportent des systèmes de protection pour éviter les évènements de rétrotransposition.
Il a été montré chez des souris que de l’ARN extracellulaire absorbé par des spermatozoïdes (et rétrotranscrit en ADN) pouvait être délivré à l’oocyte lors de la fertilisation, puis transmis aux embryons (2 et 4 cellules) et enfin propagé (irrégulièrement) dans les tissus des descendants à l’âge adulte. Les individus issus de cette fécondation peuvent transmettre ces molécules d’ADN à leurs descendants, de manière non mendélienne, et elles seront aussi irrégulièrement propagées dans leurs tissus à l’âge adulte. Le fait que ces molécules d’ADN soient irrégulièrement distribuées dans l’organisme et que leur hérédité soit non mendélienne et des études ultérieures suggèrent que ces molécules ne sont pas intégrées au chromosome et restent probablement dans le spermatozoïde sous forme d’épisome, leur reproduction étant indépendante de celle de l’ADN nucléaire. Etant donné que l’ARN internalisé par les spermatozoïdes peuvent contenir à peu près n’importe quelle information génétique, il est possible qu’un nouveau trait phénotypique soit ainsi transmis à la descendance par ce processus.