Atome - Définition
La liste des auteurs de cet article est disponible ici.
Historique des modèles de l'atome
Dans l'histoire des sciences, plusieurs modèles de l'atome ont été développés, au fur et à mesure des découvertes des propriétés de la matière. Aujourd'hui encore, on utilise plusieurs modèles différents ; en effet, le modèle le plus récent est assez complexe, l'utilisation de modèles « anciens » ou partiellement faux, mais plus simples, facilite la compréhension, donc l'apprentissage et la réflexion.
Depuis l'antiquité grecque, on supposait que la matière pouvait se fractionner en petits morceaux jusqu'à obtenir des grains insécables, qu'elle était comme « de la poussière dans la lumière ». C'est avec l'expérience de Rutherford que l'on atteint enfin ce grain : les particules alpha, en traversant la matière, voient leur trajectoire perturbée, ce qui va permettre enfin de savoir comment est organisée cette « poussière »...
- 1675 : Jean Picard observe une luminescence verte en agitant un tube de baromètre ; on découvrira quelques siècles plus tard que cela est dû à l'électricité statique et aux vapeurs de mercure ;
- 1854 : Geissler et Plücker découvrent les rayons cathodiques, des rayons verts luminescents lorsque l'on établit une forte tension électrique dans une ampoule dont on a pompé l'air (faible pression de gaz) ; ils inventent ainsi la lampe à décharge, qui éclaire maintenant nos supermarchés d'une lumière blanche, nos rues et nos stationnements d'une lumière orange (lampes au sodium) ;
- 1897 : J. J. Thomson établit que ces rayons cathodiques sont constitués de particules chargées négativement arrachées à la matière, et découvre ainsi l'électron ; c'est la première décomposition de l'atome ;
- 1900 : Max Planck montre la quantification des échanges d'énergie dans la matière (recherches sur le corps noir) ;
- 1911 : expérience de Rutherford : il bombarde une feuille d'or par des particules alpha (des noyaux d'hélium, chargés positivement, obtenus par radioactivité) ; il en déduit que :
- la plupart des particules vont en lignes droites, donc la matière est « pleine de trous » ;
- mais certaines sont déviées et même rebroussent chemin, donc elles rencontrent des îlots très concentrés de matière chargée positivement (les + se repoussent entre-eux).
- Il en déduit le modèle atomique planétaire : l'atome est constitué d'un noyau positif très petit et d'électrons tournant autour ; ce modèle pose un gros problème : en tournant, les électrons devraient perdre de l'énergie par rayonnement, et donc s'écraser sur le noyau… (ex.: Capture K)
- 1913 : Niels Bohr réunit les concepts de Planck et de Rutherford, et propose un modèle atomique quantique: les orbites des électrons ont des rayons définis, il n'existe que quelques orbites « autorisées » ; ainsi, les échanges d'énergie quantifiés correspondent à des sauts entre les orbites définies, et lorsque l'électron est sur l'orbite la plus basse, il ne peut pas descendre en dessous et s'écraser (mais ce modèle n'explique pas pourquoi) ;
- 1914 : l'expérience de Franck et Hertz valide le modèle de Bohr : ils bombardent de la vapeur de mercure avec des électrons ; l'énergie cinétique perdue par les électrons traversant les vapeurs est toujours la même ;
- 1924 : Louis de Broglie postule la dualité onde-corpuscule ;
- 1926 : Schrödinger modélise l'électron comme une onde, l'électron dans l'atome n'est donc plus une boule mais un « nuage » qui entoure le noyau ; ce modèle, contrairement aux autres, est stable car l'électron ne perd pas d'énergie.
Modèles obsolètes
Les modèles présentés dans cette section sont trop éloignés de la réalité pour pouvoir être utilisés. Ils ne sont présentés ici qu'à titre historique.
Le modèle de J.J. Thomson ou modèle de l'électron élastiquement lié a l'atome
Avec la découverte de l'électron en 1897, on savait que la matière était composée de deux parties : une négative, les électrons, et une positive, le noyau. Dans le modèle imaginé alors par Joseph John Thomson, les électrons, particules localisées, baignaient dans une « soupe » positive, à l'image des pruneaux dans le far breton (ou dans le plum-pudding pour les Britanniques ou encore comme des raisins dans un gâteau). Ce modèle fut invalidé en 1911 par l'expérience d'un de ses anciens étudiants, Ernest Rutherford.
Le modèle planétaire de Rutherford
L'expérience de Rutherford met en évidence que les charges positives ne sont pas « étalées » entre les électrons, mais sont concentrées en de petits points. Il bombarda une fine feuille d'or par un faisceau de particules alpha (particules de charges électriques positives). Il observa que les particules étaient déviées faiblement, ce qui ne correspondait pas au résultat prévu par le modèle de Thomson, pour lequel, elles n'auraient pas dû la traverser.
Rutherford imagine donc un modèle planétaire : l'atome est constitué d'un noyau positif autour duquel tournent des électrons négatifs. Entre le noyau - très petit par rapport à l'atome (environ 100 000 fois) - et ses électrons, un très grand vide existe.
Ce modèle fut très vite mis en défaut par les équations de Maxwell d'une part, qui prédisent que toute charge accélérée rayonne de l'énergie, et par les expériences montrant la quantification des niveaux d'énergie d'autre part.
Modèles approchés couramment employés
Le modèle des sphères dures
Le modèle le plus simple pour représenter un atome est une boule indéformable. Ce modèle est très utilisé en cristallographie. Une molécule peut se voir comme plusieurs boules accolées, un cristal comme des boules empilées. On utilise parfois une représentation « éclatée » : les atomes sont représentés comme des petites boules espacées, reliées par des traits, permettant de faire ressortir les directions privilégiées, les angles et de visualiser le nombre des liaisons.
Ce modèle correspond bien à certaines propriétés de la matière, comme, par exemple, la difficulté de comprimer les liquides et les solides, ou bien le fait que les cristaux ont des faces bien lisses. En revanche, il ne permet pas d'expliquer d'autres propriétés, comme la forme des molécules : si les atomes n'ont pas de direction privilégiée, comment expliquer que les liaisons chimiques révèlent des angles bien définis ?
Le modèle de Bohr
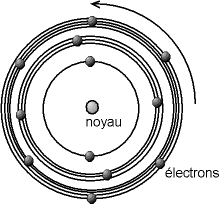
Un modèle fut développé par Niels Bohr en 1913 à partir des propriétés mises en évidence par Planck et Rutherford. Dans le modèle des sphères dures, l'atome est un objet entier, indécomposable. Or, on sait depuis le milieu du XIXe siècle que l'on peut en « arracher » des particules portant une charge électrique négative, les électrons. Dans le modèle de Bohr, l'atome est composé d'un noyau chargé positivement, et d'électrons tournant autour, les rayons des orbites des électrons ne pouvant prendre que des valeurs bien précises.
Le noyau est très compact, d'un diamètre d'environ 10-15 à 10-14 m, c'est-à-dire que le noyau est cent mille à un million de fois plus petit que l'atome ; il porte une charge électrique positive. C'est aussi la partie la plus lourde de l'atome, puisque le noyau représente au moins 99,95% de la masse de l'atome. Les électrons sont ponctuels, c'est-à-dire que leur rayon est admis quasi nul (tout du moins plus petit que ce que l'on peut estimer). Ils portent une charge négative. Pour des raisons de lisibilité, le schéma ci-dessous n'est donc pas à l'échelle, en ce qui concerne les dimensions du noyau et des électrons, ni aussi pour les rayons des différentes orbites (on notera ici que le nombre d'électrons sur les orbites n'est pas prédit par le modèle).
Cette vision permet de décrire les phénomènes spectroscopiques fondamentaux, c'est-à-dire le fait que les atomes absorbent ou émettent seulement certaines longueurs d'onde (ou couleur) de lumière ou de rayons X. En effet, le système {noyau+électrons} étant stable et confiné, d'énergie négative, il ne possède qu'un ensemble discret d'états (et donc de niveaux) d'énergie : c'est le passage d'un état à l'autre de l'atome qui provoque une émission discrète d'énergie, ce qui explique donc les raies spectroscopiques des atomes. Le modèle de Bohr, décomposant l'atome en deux parties, un noyau et un nuage d'électrons, est plus précis que le modèle des sphères dures, pour lequel la surface de la sphère correspond à l'orbite des électrons extérieurs.
Cependant, très vite, le modèle de l'atome de Bohr ne permettra pas d'expliquer l'ensemble des observations (effet Zeeman, etc.). Il faudra attendre 1924-1926 pour qu'avec Schrödinger, les orbites deviennent orbitales avec des énergies stationnaires : la Mécanique Quantique est née.