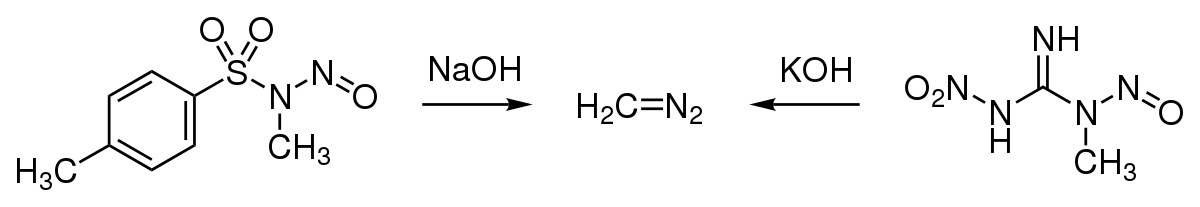Diazométhane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Diazométhane | |||
|---|---|---|---|
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| SMILES | |||
| Apparence | gaz jaune | ||
| Propriétés chimiques | |||
| Formule brute | CH2N2 | ||
| Masse molaire | 42,04 ± 0,0013 g·mol-1 | ||
| Moment dipolaire | 1,50 ± 0,01 D | ||
| Propriétés physiques | |||
| T° fusion | -145 °C | ||
| T° ébullition | -23 °C | ||
| Masse volumique | densité:1.4 (air=1) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 8,999 ± 0,001 eV (gaz) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 3, 5, 12, 23/24/25, 66, 67, | |||
| Phrases S : 9, 16, 33, | |||
| | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||
| | |||

Le diazométhane est le composé organique de formule brute CH2N2. C'est le composé diazo le plus simple. Pur, c'est un gaz jaune, mais en pratique il est utilisé en solution dans l'éther diéthylique. Il est toxique et explosif quand il est exposé à de hautes températures ou à du verre à peine rugueux, au point qu'il existe un type de verrerie adapté à sa préparation et usage.
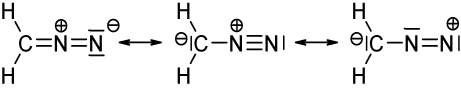
Préparation
Le diazométhane est habituellement préparé en solution dans l'éther diéthylique et utilisé immédiatement.
Il est synthétisé en dissolvant du diazald (N-méthyl-N-nitroso-p-toluènesulfonamide) dans une solution d'hydroxyde de potassium (KOH) dans l'éthanol. Le diazométhane est le gaz produit, recueilli par condensation à -70 °C.
En laboratoire, le diazométhane peut être préparé en quantité millimolaire à partir de nombreux précurseurs tels que le diazald ou le MNNG (1-méthyl-3-nitro-1-nitrosoguanidine). Du diazald en solution dans de l'éther diéthylique et du diglyme réagit avec une solution aqueuse chaude d'hydroxyde de sodium (NaOH) et le diazométhane généré est extrait par distillation.
Le diazométhane est aussi libéré d'une solution de MNNG dans l'éther par addition d'un solution d'hydroxyde de potassium à basse température.
Une autre voie possible pour la synthèse du diazométhane est l'hydrolyse basique de la N-Nitroso-N-méthylurée.
Réactions
Le diazométhane peut être utilisé pour convertir les acides carboxyliques en leur ester méthylique ou leurs homologues (réaction de Arndt-Eistert).
Dans la réaction de Buchner-Curtius-Schlotterbeck (1885), le diazométhane réagit avec un aldéhyde pour former une cétone.
Le diazométhane est surtout utilisé comme source de carbène, pour, par exemple, les réactions de cycloaddition 1,3 dipolaire dont il est l'un des principaux réactifs.
Le diazométhane réagit avec une solution basique de NaDO (D = 2H, deutérium) dans D2O pour donner CD2N2.
Titration
La concentration d'une solution de diazométhane peut être déterminée de deux façons :
- par traitement de la solution avec un excès d'acide benzoïque dans l'éther ; l'acide qui n'a pas réagi est titrée avec une solution de NaOH standard.
- par spectrométrie à 410 nm où son coefficient d'extinction molaire, ε est égal à 7,2.