Dioxyde d'azote - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Dioxyde d'azote | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | gaz brun rougeatre ou liquide brun ou jaune, d'odeur âcre. | ||
| Propriétés chimiques | |||
| Formule brute | NO2 | ||
| Masse molaire | 46,0055 ± 0,0008 g·mol-1 | ||
| Moment dipolaire | 0,316 ± 0,010 D | ||
| Propriétés physiques | |||
| T° fusion | -11,2 °C | ||
| T° ébullition | 21,2 °C | ||
| Solubilité | dans l'eau : réaction | ||
| Masse volumique | (eau = 1) : 1,45 (liquide) | ||
| Pression de vapeur saturante | à 20 °C : 96 kPa | ||
| Point critique | 157,85 °C, 20,17 MPa | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,586 ± 0,002 eV (gaz) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 26, 34, | |||
| Phrases S : (1/2), 9, 26, 28, 36/37/39, 45, | |||
| | |||
| |||
| | |||




| |||
| | |||



Danger | |||
| Inhalation | Mortel, apparition d'acide nitrique dans les poumons par réaction avec l'eau | ||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,05 ppm haut : 0,14 ppm | ||
| | |||
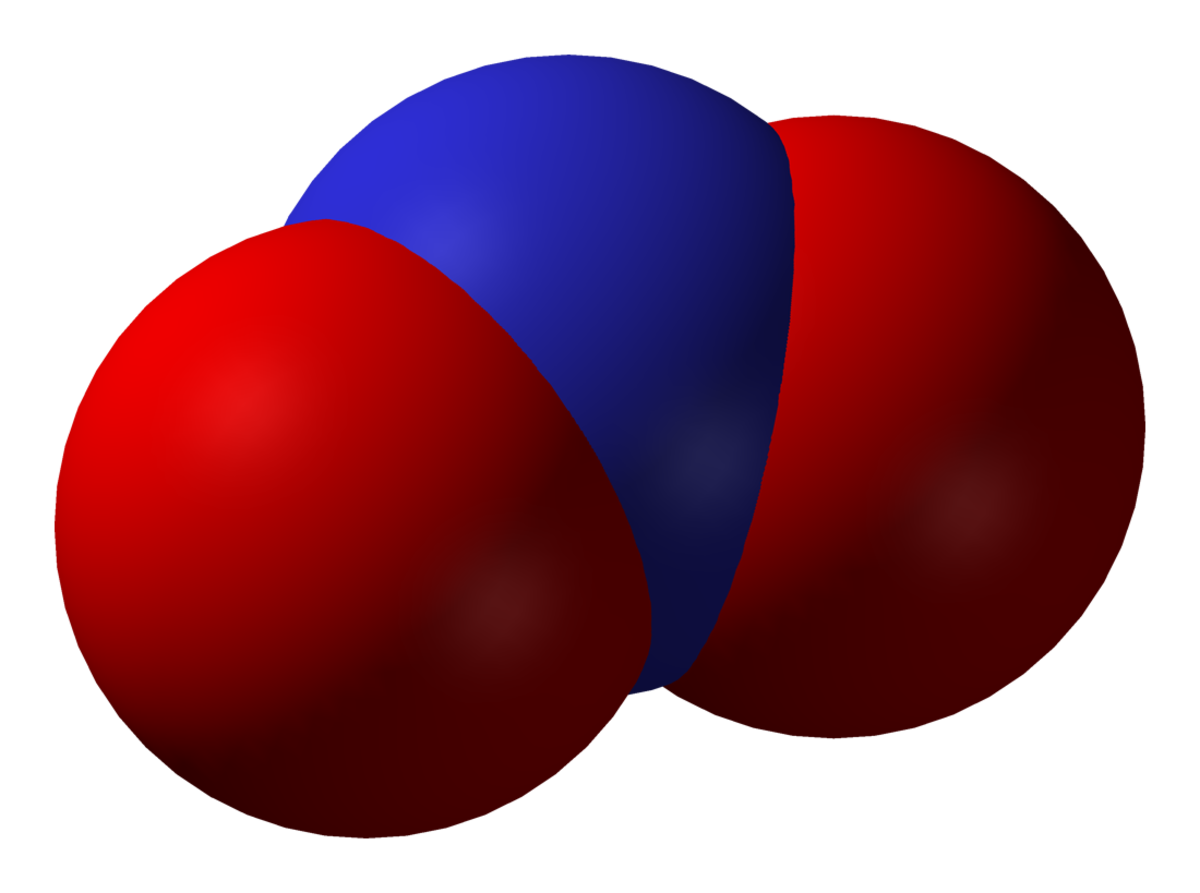
Le dioxyde d'azote (NO2) est une molécule de masse molaire égale à 46 g/mol et composée de deux atomes d'oxygène et d'un atome d'azote. C'est un gaz brun-rougeâtre, suffocant dans les conditions normales de température et de pression.
Apparence
Il présente une coloration brunâtre (vapeurs rutilantes) et une odeur douçâtre. C'est une des odeurs que l'on perçoit dans les rues polluées par la circulation automobile.
Équilibre monomère-dimère
Ce gaz a un équilibre permanent, mais dépendant des conditions de température et de pression, avec son dimère le peroxyde d'azote (N2O4).
Équation d'équilibre :
2 NO2 ↔ N2O4
Cet équilibre est caractérisé par une enthalpie de : ΔH = -57,23 kJ/mol.
Cette dimérisation est donc favorisée à basses températures. Le peroxyde d'azote N2O4, corps diamagnétique transparent peut être obtenu en un solide fondant à -11,2 °C.
Et il se retransforme réversiblement en NO2, le monomère paramagnétique coloré, en une réaction endothermique à plus hautes températures.

Structure
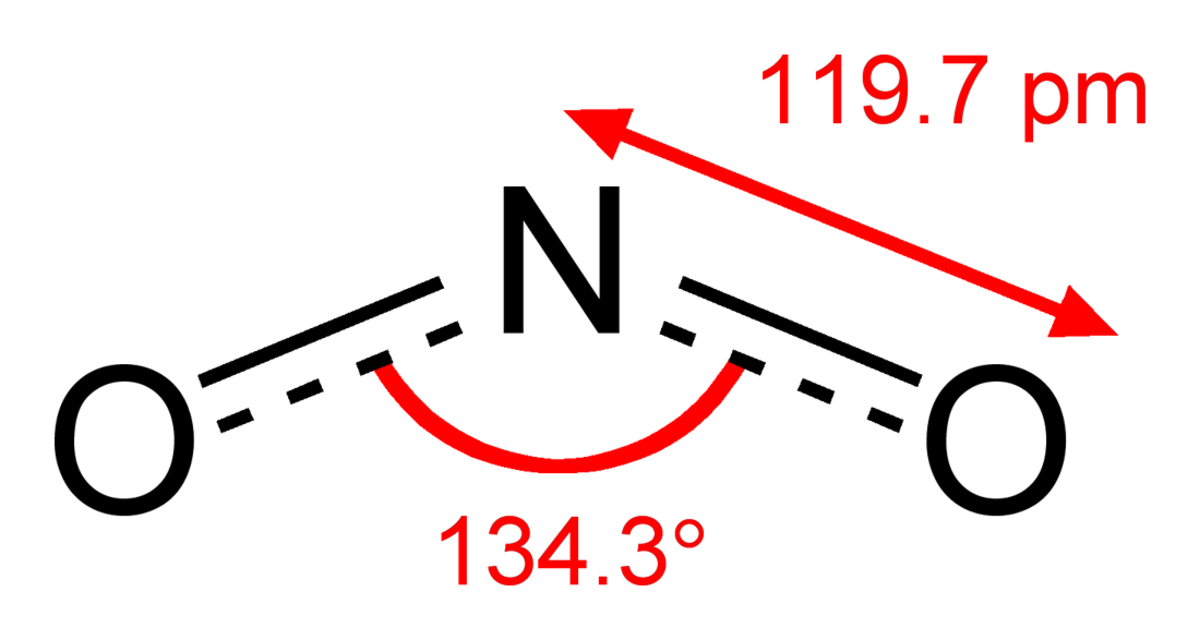
La structure plus correcte de NO2 est O-N·-O avec un angle de 134 degré et le point représentant cet électron célibataire sur l'atome d' azote, et des tirets entre les deux N-O en plus de l'existence de la liaison "normale" N-O. Les charges formelles seraient plus élevées que celles de la structure présenté ; sa présence sur l'atome N est plus proche de la réalité, bien que tout ceci n'est qu'une question de densité de probabilité de présence de l'électron en cause. Il passe "plus de temps" sur l'azote que sur un des deux oxygènes.
Sa structure radicalaire le rend très réactif vis-à-vis des molécules organiques.