Nombre d'oxydation - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En chimie, l'état d'oxydation, décrit par le nombre d'oxydation (n.o.) ou le degré d'oxydation (d.o.), caractérise l'état électronique d'une espèce chimique (molécule, ion, radical) par rapport à l'état élémentaire neutre servant de référence (n.o. = 0).
Dans le cas d'ions monoatomiques, il correspond à la valeur de la charge portée par l'ion (exemple : n.o.(Na+) = +1). En revanche, dans le cas des autres espèces chimiques, il indique le nombre d'électrons que chaque atome aurait donné ou reçu par rapport à l'état neutre si les liaisons dans lesquelles ces atomes sont impliqués étaient de nature purement ionique (voir Liaison ionique). En réalité, sauf dans le cas ou la différence d'électronégativité entre deux éléments est très importante, les liaisons sont covalentes et présentent un caractère ionique partiel, ce qui signifie qu'il y a un transfert de charge partiel entre les atomes liés. Si l'électronégativité des deux atomes liés est la même (par exemple, si les atomes liés sont un même élément), alors la liaison ne contribue pas au calcul du n.o.
Le nombre d'oxydation est une approximation conceptuelle commode lorsque l'on considère les réactions d'oxydo-réduction et les réactions électrochimiques. Il facilite le suivi des électrons et aide à vérifier qu'ils sont bien conservés.
Définition
Les atomes sont définis comme ayant un n.o. nul car ils sont électriquement neutres : les charges positives des protons du noyau équilibrent les charges du nuage d'électrons négatifs qui l'entoure.
Si un atome perd un électron, il possède plus de protons que d'électrons et devient un ion positif. On dit que cet ion a un nombre d'oxydation égal à +1 (n.o. = +1). Réciproquement, si un atome accepte un électron, il devient chargé négativement et son nombre d'oxydation devient -1 (n.o.= –1).
Règles définissant le nombre d'oxydation
Le nombre d'oxydation est abrégé par n.o.
Règles générales
- Dans une espèce chimique hétéropolyatomique (composée d’atomes de nature différente), l’atome ayant le plus d’affinité pour les électrons, c’est-à-dire le plus électronégatif, est considéré comme recevant les électrons.
Exemple : H2O correspond à 2 H(+I) et O(-II)
- Dans une espèce chimique neutre (molécule ou radical), la somme des n.o. des atomes constitutifs est nulle. En revanche si le composé est ionique, cette somme est égale à la charge de l’ion.
Exemple : SO42- (ion sulfate) correspond à S(VI) et 4 O(-II)
- Dans une espèce chimique homopolyatomique neutre (composée d’atomes de même nature), le n.o. de chaque atome est nul.
Exemple : O2 (dioxygène) ; O3 ( ozone ); N2 (diazote)
Cas particulier d'une espèce homopolyatomique ionique : Hg22+ (ion dimercure(+I) constituant du calomel); n.o.(Hg) = +1.
- Dans une espèce chimique hétéropolyatomique, s'il y a des liaisons covalentes entre atomes de même nature, elles ne contribuent pas au calcul du n.o.
Exemple : C2H6 ou H3C-CH3(éthane), les états d'oxydation sont H(I) et C(-III).
Règles usuelles
- Un corps simple élémentaire ou moléculaire a un n.o. égal à zéro (ex., n.o.(Ne) = 0 et n.o.(H2) = 0)
- Dans un composé, le fluor a toujours un n.o. égal à -1.
- Dans un composé, un alcalin (Li, Na, etc.) a toujours un n.o. égal à +1.
- Dans un composé, un alcalino-terreux (Be, Mg, etc.) a toujours un n.o. égal à +2.
- Dans un composé, l'hydrogène possède dans la quasi-généralité des cas un n.o. égal à +1, à l’exception des hydrures de métaux, tels que NaH ou LiH (hydrure de sodium ou de lithium), pour lesquels n.o.(H) = –1.
- Dans un composé, l'oxygène a le plus souvent un n.o. égal à –2. Il existe néanmoins, plusieurs exceptions :
- Dans les peroxydes, la présence d’un pont oxygène O-O induit un n.o. = –1 pour chaque oxygène.
Exemple : H2O2 qui correspond à H-O-O-H, plus connu sous le nom d’eau oxygénée. - Dans les superoxydes, c'est -1/2.
- Dans les ozonides, c'est -1/3.
- Comme le fluor est plus électronégatif que l'oxygène, dans la molécule OF2 (fluorure d'oxygène), le n.o. de l'oxygène est +2.
- Dans les peroxydes, la présence d’un pont oxygène O-O induit un n.o. = –1 pour chaque oxygène.
Application à une structure de Lewis
Quand la structure de Lewis d'une molécule est disponible, les nombres d'oxydation peuvent être calculés à partir des électrons de valence :
- Les électrons dans une liaison chimique entre deux atomes différents « appartiennent » à l'atome ayant l'électronégativité la plus élevée ;
- Les électrons appartenant à une liaison partagée par deux mêmes atomes sont également partagés;
- Les électrons dans une paire d'électrons (paire seule) appartiennent exclusivement à l'atome ayant une telle paire.
Par exemple, considérons la molécule d'acide acétique :
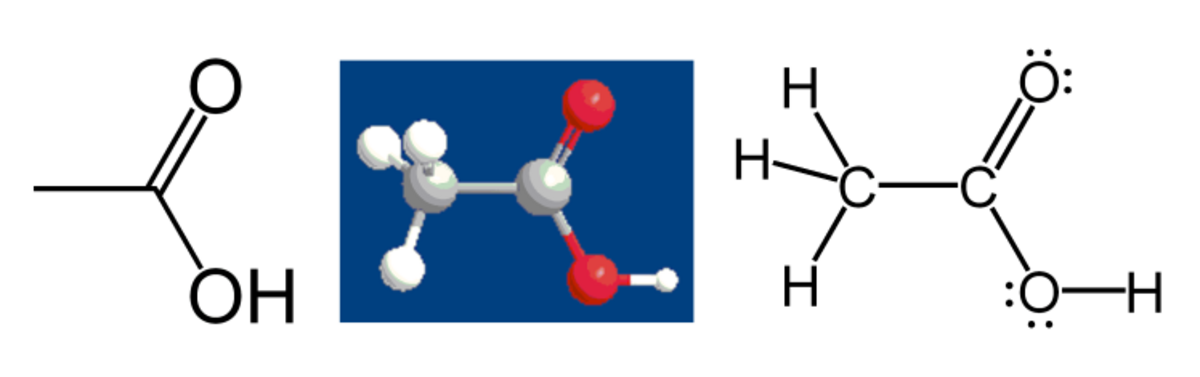
Tous les atomes d'hydrogène ont un nombre d'oxydation de +1, car ils "donnent" leur électron aux autres atomes liés qui ont une électronégativité plus élevée.
L'atome de carbone dans le groupe méthyle (CH3) a 3 × 2 = 6 électrons de valence de ses liaisons avec les trois atomes hydrogène. De plus, l'atome de carbone obtient un électron de sa liaison avec l'autre atome de carbone, car la paire d'électrons est partagée également dans la liasion C-C. Le décompte est donc de 7 électrons. Un atome de carbone seul possède 4 électrons de valence (famille IV A du tableau périodique). La différence, 4 – 7 = –3, est son nombre d'oxydation. En faisant l'hypothèse que toutes les liaisons sont ioniques (ce qui n'est pas le cas ici), l'atome de carbone peut être représenté par C3-.
En appliquant les mêmes règles pour l'acide carboxylique (COOH), l'atome de carbone a un nombre d'oxydation de +3. Il obtient un seul électron de sa liaison avec l'autre atome de carbone. Les deux atomes d'oxygène « empruntent » tous les autres électrons car ils sont plus électronégatifs que le carbone. Un atome d'oxygène seul comporte 6 électrons de valence. Chaque atome d'oxygène est entouré de 8 électrons : 4 des paires seules et 4 des liaisons. En conséquence, leur nombre d'oxydation est 6 - 8 = -2.

















































