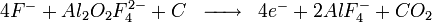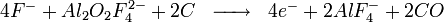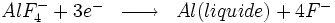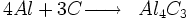Production de l'aluminium par électrolyse - Définition
La liste des auteurs de cet article est disponible ici.
Détail
Le bain d'électrolyse
La cryolithe est un composé défini de NaF (60%pds) et AlF3 (40%pds). Il existe deux types de bains cryolithiques:
- Les bains basiques, mélanges de cryolithe et de NaF ( NaF>60% et AlF3 < 40%pds),
- Les bains acides, mélanges de cryolithe et d'AlF3 ( NaF<60% et AlF3 > 40%pds).
Cette acidité en sel fondu est une acidité au sens de Lewis. Selon Lewis, un acide possède un atome susceptible de se fixer sur un doublet électronique libre alors qu'une base de Lewis est une espèce chimique possédant un doublet libre (aussi appelé doublet non liant). Ici la molécule acide est le fluorure d'aluminium AlF3. On y définit aussi un pF=-log([F-]) par analogie au pH ou pOH. Les professionnels parlent en termes de Cryolithe Ratio (CR=NaF(%mol)/AlF3(%mol)) ou (BR) Bath Ratio.
Le bain d'électrolyse est constitué principalement de :
- un fluorure d'aluminium et de sodium : la cryolithe. Elle représente environ 80% de la masse du bain d'électrolyse. La cryolite a comme composition : (AlF3, 3NaF). Initialement extraite au Groenland elle est désormais en majorité synthétique. La cryolithe a son point de fusion à 1 010 °C sous 1atm.
- En fonction de l'acidité: du fluorure d'aluminium AlF3 ou de sodium NaF. Représente environ 10% de la masse du bain d'électrolyse.
- Du fluorure de calcium : CaF2 qui est pratiquement inerte mais baisse les pressions partielles des composés du bain d'où une diminution de l'évaporation du bain et une minimisation de l'insertion de sodium dans la cathode. Représente environ 5% de la masse du bain d'électrolyse.
La composition ionique du bain serait donc : Na+, F-, AlF3, AlF4-, et AlxOyFz3x-2y-z.
Etant donné que tous les composants de l'électrolyte sont (sans exceptions) ioniques et complexes il n'existe pas de théorie permettant la description des composants du bain. Pourtant les spécialistes utilisent la formule AlXOYFZ3x-2y-z plus proche de la réalité que Al3+, O2- et F-.
Un point important dans la composition du bain est sa densité. La densité du bain est en général proche de 2 ce qui permet de faire couler au fond de la cellule l'aluminium métal de densité 2,7.
Réactions à l'anode
Il existe deux types de cuves électrolytiques. Celle présentée dans la figure ci-dessus est appelée cuve à anodes précuites, désormais ce type de cuve est majoritaire. L'autre type de cuve est appelé cuve Söderberg dans laquelle la cuisson de l'anode se fait in situ. Cette cuve est de moins en moins utilisée car en plus de polluer plus elle génère de moins bons rendements. L'anode est en carbone. Elle est fabriquée à l'aide de coke de pétrole calciné (coke de brai) et brai de houille.
A l'anode, on a la réaction suivante :
On a également la réaction secondaire suivante :
Une réaction néfaste pour la cellule et l'environnement a lieu lorsque l'alumine vient à manquer dans la cellule. Cette réaction est néfaste car elle génère des fluorures de carbone. Ces fluorures détruisent la couche d'ozone et provoquaient autrefois (avant le captage de la majorité des gaz en usine) la maladie de la fluorose chez les animaux par substitution de l'hydroxyapatite des os en fluoroapatite... Cette réaction est néfaste pour la cellule car elle génère un gaz bloquant l'anode en s'y fixant (à la différence du CO2), le passage du courant est altéré et génère alors une surchauffe par effet Joule. Cette réaction est la suivante:
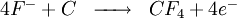
Réactions à la cathode
Le pôle négatif de la cellule est en carbone. Ce bloc de carbone est en permanence recouvert d'aluminium liquide, l'ensemble bloc et métal liquide constitue la cathode. Les bordures latérales du bloc graphite sont protégées par du bain figé qui l'isole thermiquement et limite son usure (non représenté sur le schéma ci dessus), ce bain figé est appelé talus.
A la cathode, nous avons les réactions électrochimiques suivantes :
- Réaction primaire :
- Réactions secondaires :
les produits de ces deux réactions provoquent l'endommagement progressif de la cathode. Le sodium en s'insérant la fait gonfler, fléchir puis fissurer. Les carbures d'aluminium solubles partent en solution et érodent le bloc. Il faut donc périodiquement remplacer les cathodes qui constituent le fond de la cuve d'électrolyse : c'est l'opération de rebrasquage.
Sous l'effet de la force de Laplace l'aluminium métal se met en mouvement, les vagues de métal liquide ainsi provoquées génèrent des court-circuits en allant toucher l'anode. L'aluminium de cette vague est immédiatement réoxydé en alumine.
L'aluminium liquide est régulièrement pompé (sans en retirer la totalité). L'aluminium est ensuite transporté dans des fours de maintien pour en ajuster la composition, et la rendre conforme aux spécifications du client.
Aspects technologiques
Pour produire une tonne d’aluminium, la réaction requiert 0,415 tonnes de carbone, 1,920 tonnes d’alumine tandis que 650 m3 de dioxyde de carbone sont produits par la combustion des anodes. Le chauffage de la cellule, appelée aussi cuve d'électrolyse, est entièrement généré par effet Joule.
La cuve d'électrolyse se compose des éléments suivants :
- un caisson en acier,
- un garnissage isolant thermique constitué de briques réfractaires,
- un creuset polarisé cathodiquement constitué d'un assemblage de blocs de carbone cuits à base d'anthracite et liés par une pâte carbonée appelée pâte de brasque,
- des barres d'acier traversant le caisson et permettant la sortie (pole négatif) du courant à la cathode,
- des ensembles anodiques constituées de tiges en aluminium sur une superstructure en acier, une liaison entre ces tiges et les blocs de carbone, des blocs de carbone appelés anodes,
- un ensemble de conducteurs en aluminium qui transportent le courant de la cathode de la cuve précédente de la série de cuves vers l'anode de la cuve suivante,
- un système d'aspiration des gaz vers la station de traitement,
- un système d'alimentation en alumine.
La distance entre l’anode et le métal est ajustée par des moteurs qui descendent progressivement les anodes en fonction de leur consommation par la réaction électrochimique. Par ailleurs, deux opérations principales sont effectuées régulièrement :
- le soutirage de l’aluminium, qui s’effectue par aspiration dans une poche de coulée grâce à un tuyau en fonte plongé dans la couche de métal liquide,
- le remplacement des anodes consommées, chaque anode durant environ 25 jours.
De manière à assurer la qualité de la production, de nombreux contrôles sont effectués : mesure de la hauteur de métal et de bain, prélèvement et analyse du métal, suivi de la température et des paramètres électriques. Une régulation automatisée des paramètres de marche a permis d’améliorer grandement le rendement du procédé et de réduire les émissions de gaz a effet de serre.
Les cuves modernes sont constituées d’une vingtaine d’anodes soumises à une densité de courant de 0,8 A/cm2. Une série électrique de cuves est constituée de deux rangées parallèles (parfois 2x180 cuves), dans deux halls de 1km de long séparés et éloignés de 50 à 100m. Une cuve de 360 000 ampères produit environ 1 000 tonnes d'aluminium par an. Une série de 360 cuves à 360 000 A (technologie de 2008) produit 360 000 tonnes d'aluminium par an.
Aspects énergétiques
A l'origine, les cuves (les marmites) avaient une intensité de 5000 à 6000 A pour un voltage de 6 à 7 V. Actuellement (cas de l'usine Alcan de Dunkerque) les cuves ont une intensité de 350 000 A pour un voltage de 4,20 V. Seuls 1,18 V sont théoriquement nécessaires à la réaction, le reste est dû aux surtensions électrochimiques ainsi qu'à la chute ohmique dans l'électrolyte, les électrodes et connecteurs.
Le rendement Faraday (rapport de la masse d'aluminium produite à la masse d'aluminium théoriquement déposable) est de l'ordre de 95 % : 95% de l'électricité "utile" sert à la production et 5% est perdu dans les réactions secondaires, dont principalement :
Cette réaction est possible car anode et cathode ne sont distantes que de quelques cm ce qui peut entrainer un contact entre une bulle de CO et le métal mais aussi parce que l'aluminium métal se dissout à raison de 0,01%pds dans le bain.
5,64 MWh d’énergie électrique sont théoriquement nécessaires pour fabriquer une tonne d’aluminium. Cependant, l’énergie consommée est d’environ 13,5 MWh par tonne, du fait d’une dissipation de l’énergie par effet Joule. Ce dégagement de chaleur suffit à maintenir la température du bain aux alentours de 960 °C, mais implique également un faible rendement énergétique global, de l’ordre de 50 %.
Pour une usine d’électrolyse contenant 200 cuves alimentées par 300 000 A sous une tension de 4,20 V, le générateur d'énergie doit fournir 250 MW. En y ajoutant les auxiliaires, notamment la cuisson des anodes et la fonderie, une usine doit donc disposer d’une puissance de près de 300 MW, ce qui est considérable. Ceci représente environ un tiers de la puissance produite par une tranche d'une centrale nucléaire : l'installation d'une usine de production d'aluminium se fait généralement à proximité d'une centrale électrique.