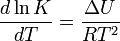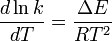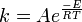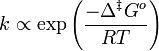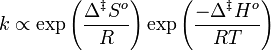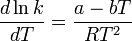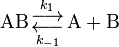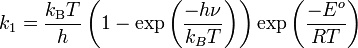Théorie de l'état de transition - Définition
La liste des auteurs de cet article est disponible ici.
Développement
Durant le développement de la théorie, trois approches ont été employées, résumées ci-après.
Approche thermodynamique
En 1884, Jacobus van't Hoff proposa la relation indiquant la dépendance en température de la constante d'équilibre d'une réaction réversible :
- A = B
où ΔU est la modification d'énergie interne, K la constante d'équilibre de la réaction, R la constante universelle des gaz parfaits et T la température thermodynamique. En se basant sur l'expérience, Svante Arrhenius proposa en 1889 une expression comparable pour la constante cinétique de réaction, donnée de la manière suivante :
L'intégration de cette équation donne la loi d'Arrhenius :
A était appelé facteur de fréquence (maintenant coefficient pré-exponentiel)et E est considéré comme l'énergie d'activation. Dès le début du XXe siècle, la loi d'Arrhenius était communément admise mais les interprétations physiques de A et de E restaient vagues. Cela conduisit de nombreux chercheurs à s'investir dans la cinétique chimique afin de présenter différentes théories sur le déroulement des réactions afin de lier A et E aux dynamique moléculaires qui en sont responsables.
En 1910, René Marcelin introduisit le concept d'énergie standard d'activation de Gibbs. Son équation peut être écrite comme :
Dans le même temps, les chimistes néerlandais Philip Abraham Kohnstamm, Frans Eppo Cornelis Scheffer et Wiedold Frans Brandsma introduisaient pour la première fois l'enthalpie et l'entropie standard d'activation. Ils proposèrent pour la constante cinétique l'équation :
Cependant, la nature de la constante restait peu claire.
Approche cinétique théorique
Au début de l'année 1900, Max Trautz et William Lewis étudièrent la cinétique de réaction en s'appuyant sur la théorie des collisions, basée sur la théorie cinétique des gaz. La théorie des collisions considère les molécules réactives comme des sphères dures se cognant les unes aux autres mais néglige les modifications de l'entropie.
W. Lewis appliqua cette méthode à la réaction 2HI → H2 + I2 et obtint un bon accord avec les données expérimentales.
Cependant, la même démarche appliquée à d'autres réactions donna lieu à d'importantes différences entre les résultats expérimentaux et théoriques.
Approche en mécanique statistique
La mécanique statistique a joué un rôle significatif dans le développement de la TST. Cependant, l'application de la mécanique statistique à la TST fut développée très lentement étant donné qu'au milieu du XIXe siècle, James Clerk Maxwell, Ludwig Boltzmann et Leopold Pfaundler publièrent de nombreux articles traitant des équilibres et cinétiques réactionnels en termes de dynamique moléculaire et de distribution statistique des vitesses moléculaires.
Il fallut attendre 1912 pour que le chimiste français A. Berthoud utilise la statistique de Maxwell-Boltzmann pour obtenir la constante cinétique.
où a et b sont des constantes liées aux termes d'énergie.
Deux ans après, R. Marcelin produisit une contribution essentielle au problème en considérant l'avancement de la réaction chimique comme le déplacement d'un point dans l'espace des phases. Il appliqua ensuite les méthodes de Gibbs en mécanique statistique et obtint une expression similaire à celle qu'il avait obtenue précédemment à partir de considérations thermodynamiques.
En 1915, une autre contribution importante fut produite par le physicien britannique James Rice. Il conclut sur la base d'une analyse statistique que la constante de réaction est proportionnelle à l'« incrément critique ». Ses idées furent développées plus avant par R. Tolman. En 1919, le physicien autrichien Karl Ferdinand Herzfeld appliqua la mécanique statistique à la constante d'équilibre et la théorie cinétique à la constante cinétique d'une réaction inverse, k-1, pour la dissociation réversible d'une molécule diatomique.
Il obtint l'équation suivante pour la constante cinétique pour cette réaction :
dans laquelle
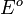
En 1920, le chimiste américain Richard Chase Tolman développa l'idée de Rice sur l'« incrément critique ». Il conclut que cet incrément critique (connu maintenant sur l'appellation d'énergie d'activation) d'une réaction est égal à l'énergie moyenne de l'ensemble des molécules subissant la réaction moins l'énergie moyenne des molécules réactives.
Surfaces d'énergie potentielle
Le concept de surface d'énergie potentielle fut très important dans le développement de la TST. La base de ce concept fut posée par R. Marcelin. Il postula que l'avancement d'une réaction chimique pouvait être décrit comme un point de la surface d'énergie potentielle avec des coordonnées fonctions des vitesses des atomes et des distances.
En 1931, Henry Eyring et Michael Polanyi décrivirent la surface d'énergie potentielle de la réaction H + H2 → H2 + H. Cette surface est un diagramme tridimensionnel basé sur les principes de mécanique quantique ainsi que sur des données expérimentales sur les fréquences de vibration et les énergies de dissociation.
Un an après cette construction, H. Pelzer et E. Wigner produisirent une contribution importante en suivant l'avancement de la réaction sur la surface d'énergie potentielle. Ce travail discutait pour la première fois du concept de col (ou de point selle) sur la surface d'énergie potentielle. Ils en conclurent que la cinétique de réaction est déterminée par le mouvement du système par ce col.