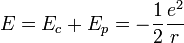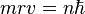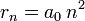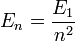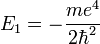Modèle de Bohr - Définition
Le modèle de Bohr est une théorie physique, basée sur le modèle planétaire de Rutherford cherchant à comprendre la constitution d'un atome, et plus particulièrement, celui de l'hydrogène et des ions hydrogénoïdes (ions ne possédant qu'un seul électron)
Principe
|
|---|
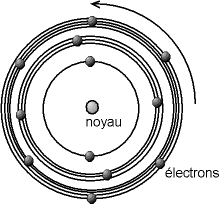
Ce modèle est un complément du modèle planétaire d'Ernest Rutherford qui décrit l'atome d'hydrogène comme un noyau massif et chargé positivement, autour duquel se déplace un électron chargé négativement.
Le problème posé par ce modèle est que l'électron, charge électrique accélérée, devrait selon la physique classique, rayonner de l'énergie et donc finir par s'écraser sur le noyau.
Niels Bohr propose d'ajouter deux contraintes :
- L'électron ne rayonne aucune énergie lorsqu'il se trouve sur une orbite stable (ou orbite stationnaire). Ces orbites stables sont différenciées, quantifiées. Ce sont les seules orbites sur lesquelles les électrons peuvent graviter.
- L'électron ne rayonne ou n'absorbe de l'énergie que lors d'un changement d'orbite.
Ainsi les orbites possibles de l'électron sont décrites comme des cercles de diamètres quantifiés.
Théorie
L'atome d'hydrogène est modélisé par un électron de masse m gravitant autour du proton.
L'énergie mécanique
L'interaction entre ces deux particules est électrostatique: la force intervenant est la force de Coulomb. Ceci nous permet donc d'écrire l'énergie potentielle de l'électron à une distance r du noyau :
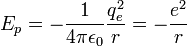
- ε0 est la permittivité du vide
- qe est la charge de l'électron
-
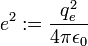
D'autre part, comme il est question d'un mouvement à force centrale, l'accélération de cet électron vaut
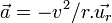
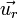
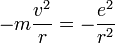
On peut alors calculer l'énergie cinétique :
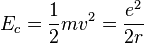
Finalement, on obtient l'énergie mécanique :
|
|
Quantification
Ici intervient alors la quantification du moment cinétique
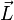
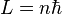
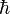
Cette relation s'écrit :
|
|
Résultats
- Les deux équations précédentes:
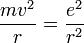
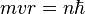
permettent de calculer la distance entre le noyau et l'électron, r ( ainsi que la vitesse v ):
|
|
- où
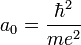
- L'énergie totale de l'électron est aussi quantifiée :
|
avec
|
- E1 est une unité d'énergie, appelée énergie de Rydberg (cf constante de Rydberg), et vaut environ -13.6 eV.
- Néanmoins cette théorie, même modifiée par Sommerfeld pour tenir compte des orbites elliptiques, ne survivra pas à la révolution de la mécanique quantique en 1926.
Note historique
- Durant le XVIIIème et le XIXème siècle, on mesure, par spectroscopie, des spectres de différentes sources lumineuses comme le soleil ou la lampe à hydrogène. Depuis Thomas Melvill (1726-1753) en 1750, on a observé que ces spectres sont formés de raies.
On considère que la spectroscopie théorique naît avec les lois de Bunsen (1811-1899) et Kirchhoff (1824-1887) publiées en 1859. Niels Bohr (1885-1962) est le premier à pouvoir expliquer ce phénomène de quantification en 1913.
- Il avait été guidé par l'expression simple d'une formule (dite de Balmer), qui associe les fréquences des raies composant le spectre de l'hydrogène, à la différence entre deux termes d'énergie. En effet, Balmer (1825-1898) trouva empiriquement la relation donnant les longueurs d'onde des raies :
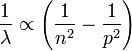
- Or la théorie planétaire de Rutherford de 1911 se heurtait à la théorie du rayonnement de l'électron accéléré. En effet, cet électron émettait de l'énergie et devait s'écraser sur le noyau au bout de quelques millions de révolutions, ce qui correspond à une nanoseconde.
- En 1913, Bohr a introduit ses deux postulats pour rendre le modèle compatible avec ces observations. Il suppose que l'électron parcourt différentes orbites circulaires quantifiées autour du noyau : lorsque l'électron change d'orbite, un photon transportant de l'énergie est émis. Les orbites deviennent donc niveaux d'énergie. Le spectre atomique de l'hydrogène, et le problème du modèle de Rutherford étaient ainsi expliqués.
- Niels Bohr publia alors en Juillet 1913 son article : On the constitution of atoms and molecules, Philosophical Magazine, series 6, vol. 26, July 1913,p 1-25.
- Dans celui-ci, il est bien expliqué pourquoi, après les expériences de Geiger (1913), il opte pour l'atome planétaire de Rutherford (1911) contre l'atome de Thomson (1904). Il indique qu'il est redevable à Planck de la notion de quanta et de la constante de Planck. Il reconnaît à l'astronome Nicholson (1912) l'idée de considérer le moment cinétique.
Quelques remarques et conséquences :
- La formule de Balmer ne satisfait pas Bohr dans la mesure où cette longueur d'onde est monochromatique, et ne correspond à aucune oscillation de l'électron : il n'y a pas de résonance.
- D'autre part, il n'y a pas de référence à la masse réduite dans cet article, alors qu'elle est souvent présentée comme un succès pour expliquer le passage de la constante de Rydberg théorique R∞ à la constante de Rydberg pour l'atome d'hydrogène RH.
- Toutefois, l'énigme de l'hydrogène de Pickering, moins citée, a pu être résolue : l'astronome Pickering publie des séries de raies qui s'accordent avec la théorie de Rydberg , mais en prenant n et m demi-entiers (1895). Fowler le confirme (Décembre 1912) dans une expérience terrestre avec un tube contenant de l'hydrogène et de l'hélium. Bohr a alors l'idée de la réaction suivante: H + He → H– + He+, et déclare que l'on voit le spectre de l'ion hydrogénoïde He+ (avec une constante de Rydberg quadruple) et que l'hydrogène de Pickering n'existe pas. De plus, il interprète alors les raies des alcalins avec des modifications légères des termes de Ritz par des entiers effectifs.
- Néanmoins sa théorie ne permet d'interpréter ni le spectre des autres atomes ni celui des molécules.
- Pour la théorie de l'état s de l'hydrogène, il faudra attendre 1926 (cf principe d'incertitude, saturation).