Acide caféique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide caféique | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | acide 3,4-dihydroxycinnamique trans-cafféate 3,4-dihydroxy-trans-cinnamate | |
| No CAS | ||
| No EINECS | ||
| DrugBank | ||
| PubChem | ||
| ChEBI | ||
| SMILES | ||
| InChI | ||
| Apparence | poudre cristalline jaune | |
| Propriétés chimiques | ||
| Formule brute | C9H8O4 | |
| Masse molaire | 180,1574 ± 0,009 g·mol-1 | |
| pKa | 4.62 | |
| Propriétés physiques | ||
| T° fusion | 234 à 237 °C (décomposition) | |
| Solubilité | peu soluble dans l'eau | |
| Masse volumique | 1,478 g·cm-3 | |
| Précautions | ||
| | ||
| ||
| Phrases R : 40, | ||
| Phrases S : 36/37, | ||
| Écotoxicologie | ||
| DL | > 721 mg·kg-1 (souris, i.p.) | |
| LogP | 1,15 | |
| | ||
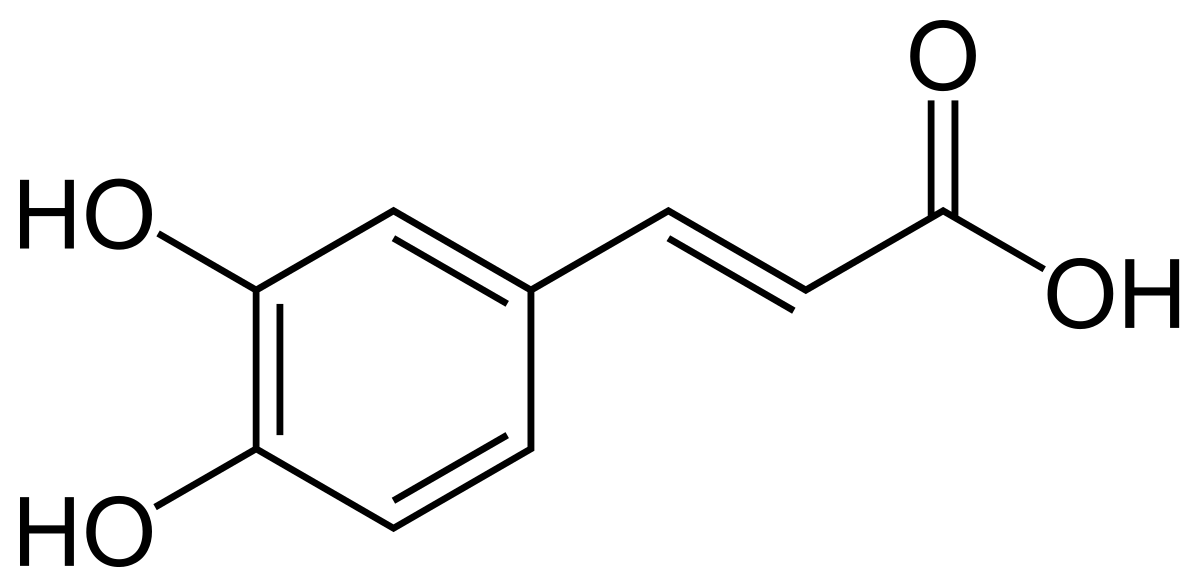
L'acide caféique ou acide (E) 3-(3,4-dihydroxyphényl)prop-2-ènoïque est un composé organique naturellement présent dans toutes les plantes car étant un intermédiaire clé dans la biosynthèse de la lignine. C'est un dérivé de l'acide cinnamique qui a une structure aussi très proche de l'acide férulique et, comme eux deux, il appartient à la grande famille des phénylpropanoïdes.
Il n'a aucun lien avec la caféine, mais est présent naturellement en très grande quantité dans le café (une tasse de café en contient 25 à 75 mg).
Structure
L'acide caféique a une structure très proche de l'acide cinnamique dont il dérive. Comme lui il présente un groupe acrylique en bout de chaîne, mais s'en différencie par la présence de deux groupes hydroxy sur le phényle qui lui donne des propriétés propres aux polyphénols.
Application
Kraft Foods a breveté en 1993 l'utilisation de l'acide caféique et de ses sels (de 0,001% à 0,2%) comme masqueur de l'arrière goût amer d'édulcorant artificiels tels que l'acésulfame potassium et la saccharine.
Occurrence et rôle biologique
L'acide caféique et son dérivé, l'ester caféate de phénéthyle (caffeic acid phenetyl ester - CAPE, ester de l'acide caféique et du 2-phényléthanol), sont présents dans presque toutes les plantes et en particulier en grande quantité dans le café, d'où il fut isolé pour la première fois au XIXe siècle et dont il tire son nom. En général, il est présent sous forme estérifiée, principalement avec l'acide quinique avec lequel il forme l'acide chlorogénique. On rencontre ce dernier particulièrement dans le café mais aussi dans la pomme. Parmi les autres formes estérifées courantes, on trouve l'acide caféoyltartrique (ou acide caftarique) formé avec l'acide tartrique présent dans le raisin, l'acide caféoylshikimique (formé avec l'acide shikimique) naturellement présent dans la datte, l'acide caféoylmalique (formé avec l'acide malique) naturellement présent dans le radis, ou encore estérifiée avec du glucose (caféoylglucose) ou sous forme d'amide avec la putrescine (caféoylputrescine).
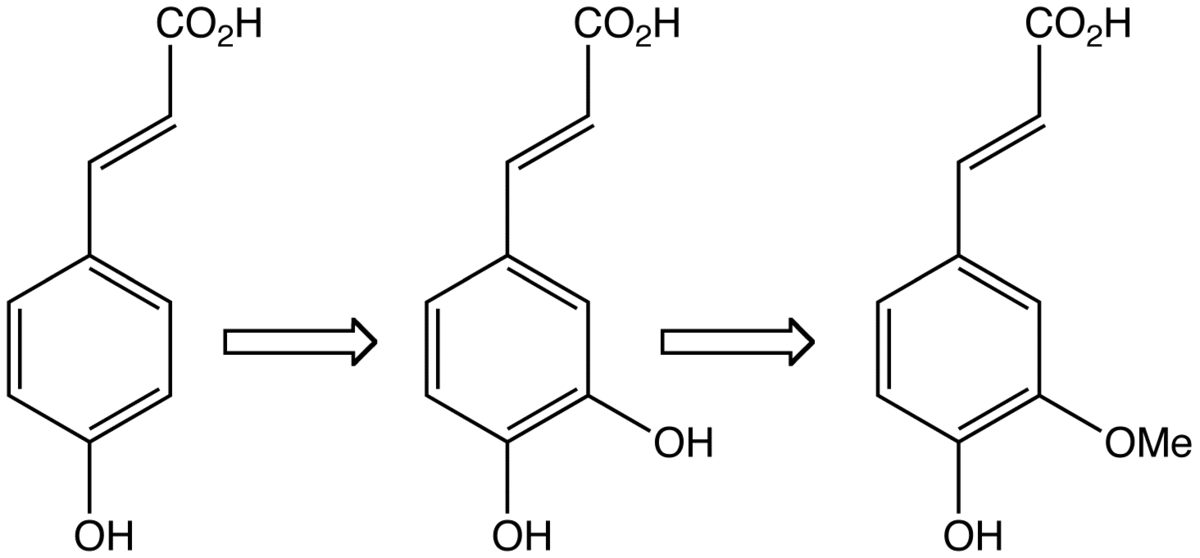
Il est biosynthétisé par hydroxylation de l'acide paracoumarique (sous forme ester), lui même obtenu par hydroxylation de l'acide cinnamique (éventuellement aussi obtenu via l'élimination du groupe amine de la tyrosine). C'est un précurseur de l'acide férulique, de l'alcool coniférylique et de l'alcool sinapylique, monomères de la lignine et de la lignane. La transformation de l'acide caféique en acide férulique est catalysée par une enzyme spécifique l'acide caféique-O-méthyltransférase.