Acide tartrique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| acide tartrique | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
| Synonymes | acide 2,3-dihydroxy succinique |
| No CAS | L(+) ou (2R,3R) D(−) ou (2S,3S) meso ou (2R,3S) (racémique) |
| No EINECS | (L) (D) (DL) |
| PubChem | |
| No E | E334 |
| FEMA | |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline blanche |
| Propriétés chimiques | |
| Formule brute | C4H6O6 |
| Masse molaire | 150,0868 ± 0,0054 g·mol-1 |
| pKa | 3,04, 4,37 |
| Propriétés physiques | |
| T° fusion | 206 °C |
| Solubilité | dans l'eau : 206 g·l-1 à 20 °C |
| Masse volumique | (eau = 1) : 1.79 |
| T° d’auto-inflammation | 425 °C |
| Point d’éclair | 210 °C (coupelle ouverte) |
| Thermochimie | |
| Cp | |
| Précautions | |
| | |
|
2 2 1 | |
| | |
Acide tartrique :
Acide tartarique (d-) : 
Acide méso-tartarique : 
Acide tartarique (l-) : 
| |
| | |
L‘acide tartrique est le nom usuel de l'acide 2,3-dihydroxybutanedioïque, qui a pour formule brute C4H6O6. Sa formule semi-développée est HOOC-CHOH-CHOH-COOH. L'acide tartrique est présent dans de nombreuses plantes. Il fut isolé pour la première fois en 1769, par le chimiste suédois Carl Wilhelm Scheele, qui fit bouillir du tartre avec de la craie et décomposa le produit en présence d'acide sulfurique. Il peut être synthétisé. C'est le principal acide du vin (provenant du raisin), sous sa forme L(+).
Les ions tartrates sont utilisés dans la liqueur de Fehling pour tester la présence d'aldéhydes. Le tartrate de potassium évite une cristallisation du vin en bouteille, phénomène exploité dès l'antiquité par les grecs et les romains.
Chimie
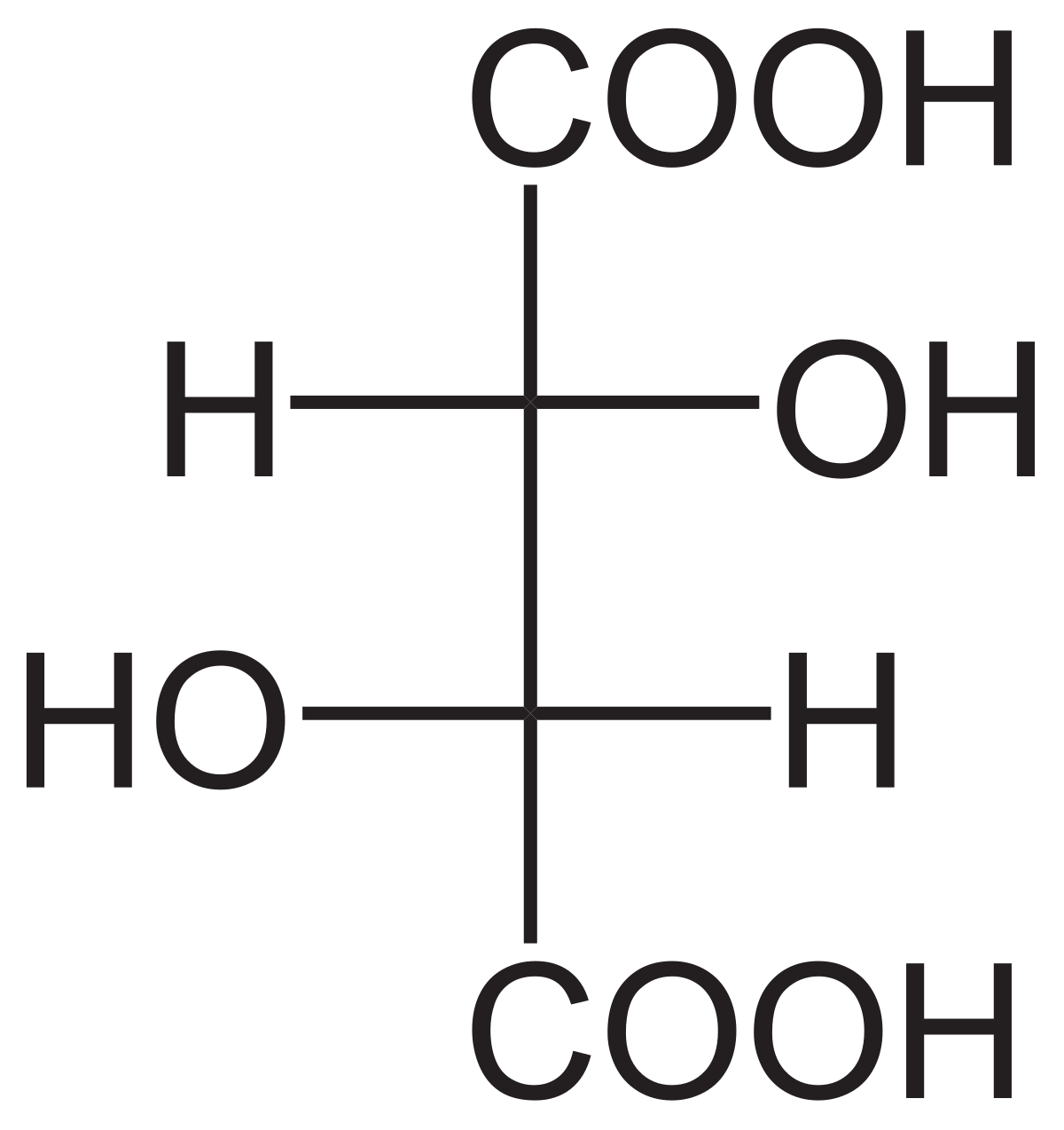
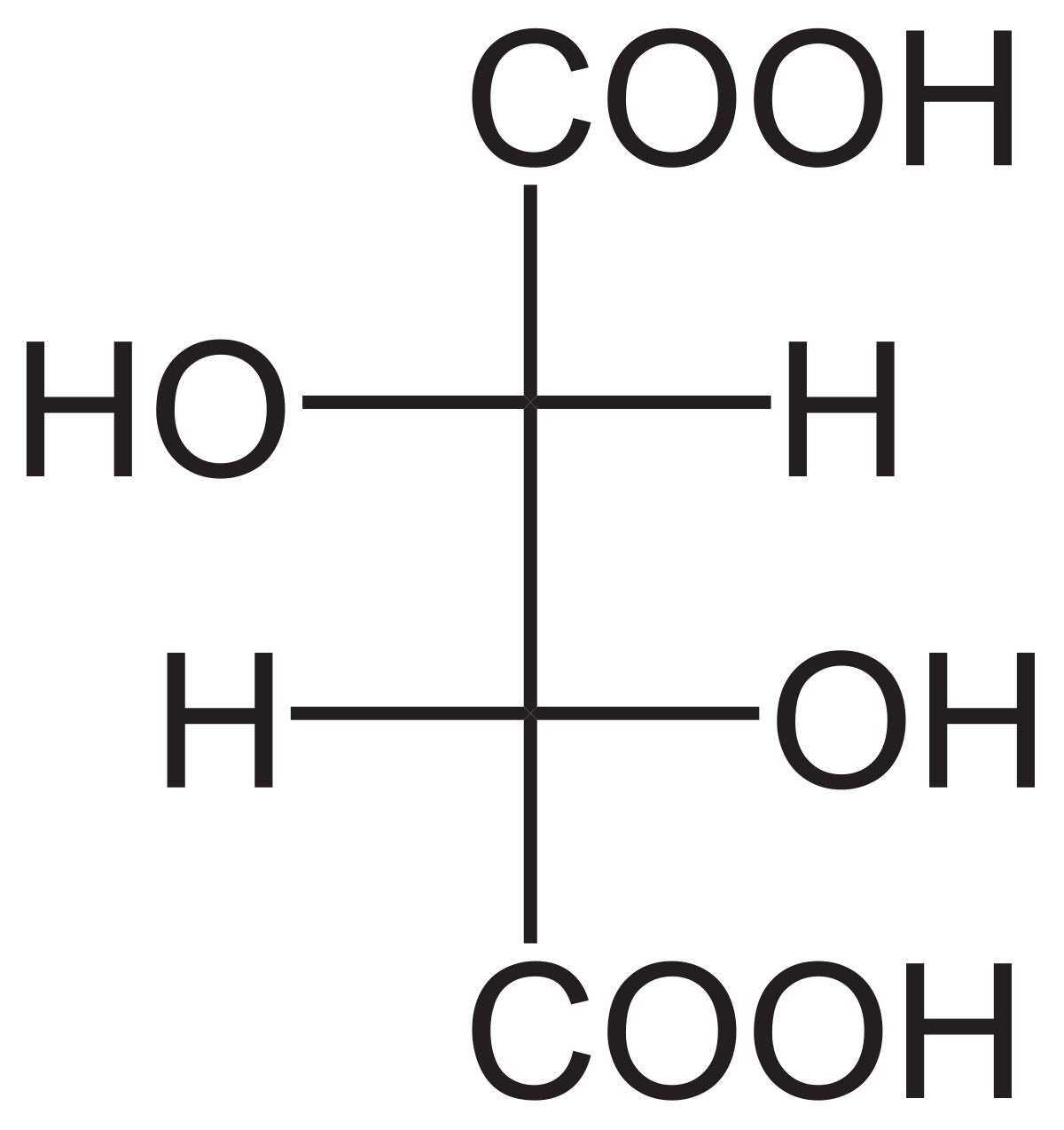
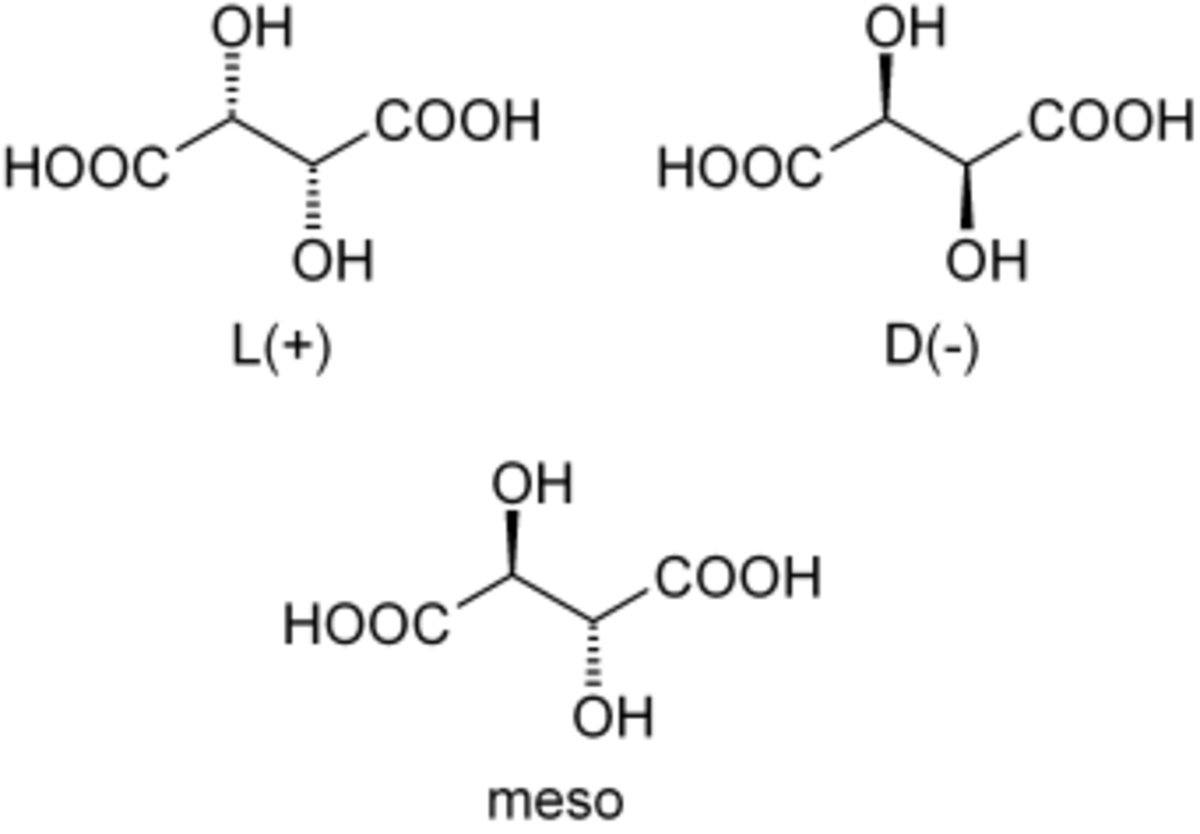
L'acide tartrique possède deux atomes de carbone asymétriques mais ne possède que trois stéréoisomères car le (R,S)-acide tartrique est un composé achiral dit "méso" car possédant deux atomes de carbone asymétriques tout en ayant un centre de symétrie.
Propriétés
L'acide tartrique active la salivation ; il est légèrement laxatif et diurétique. Il se présente sous la forme de cristaux transparents incolores solubles dans l'eau. Les sels de l’acide tartrique sont les tartrates qui sont toujours à craindre et sont évités en traitant le vin par le froid, pour éliminer le maximum de tartre, éventuellement en ajoutant un inhibiteur de cristallisation (acide métatartrique). On détecte l’acide tartrique par le résorcinol.
Isomérie
Louis Pasteur a étudié l'activité optique des isomères optiques des tartrates. La fermentation des jus de raisin produit sur la surface interne du récipient une croûte blanche de tartrate acide de potassium ou tartre brut. Le tartre brut, bouilli en présence d'acide chlorhydrique dilué, précipite sous forme de tartrate de calcium, par addition d'hydroxyde de calcium. Son traitement par de l'acide sulfurique dilué libère la forme dextrogyre (+) de l'acide tartrique, composé qui fait tourner le plan de polarisation de la lumière polarisée vers la droite. L'acide L(+)-tartrique a une température de fusion de 170 °C et est facilement soluble dans l'eau et l'alcool. Il est insoluble dans l'éther. Il existe une autre forme de l'acide tartrique, l'acide D(–)-tartrique (levogyre). Elle a la même structure que la forme L(+), mais fait tourner le plan de polarisation de la lumière vers la gauche. Cet acide fut préparé pour la première fois vers 1847 par Louis Pasteur dans le cadre de son doctorat, à partir du sel d'ammonium et de sodium. L'acide tartrique préparé en laboratoire est un mélange équimolaire des formes dextrogyre (+) et lévogyre (–). Ce mélange, dit racémique, du nom ancien de ce produit, l'acide racémique, ne modifie pas la direction du plan de polarisation de la lumière. Il existe une troisième variété, l'acide mésotartrique, qui, chirale, ne modifie pas non plus la direction du plan de polarisation de la lumière.