Couche d'ozone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
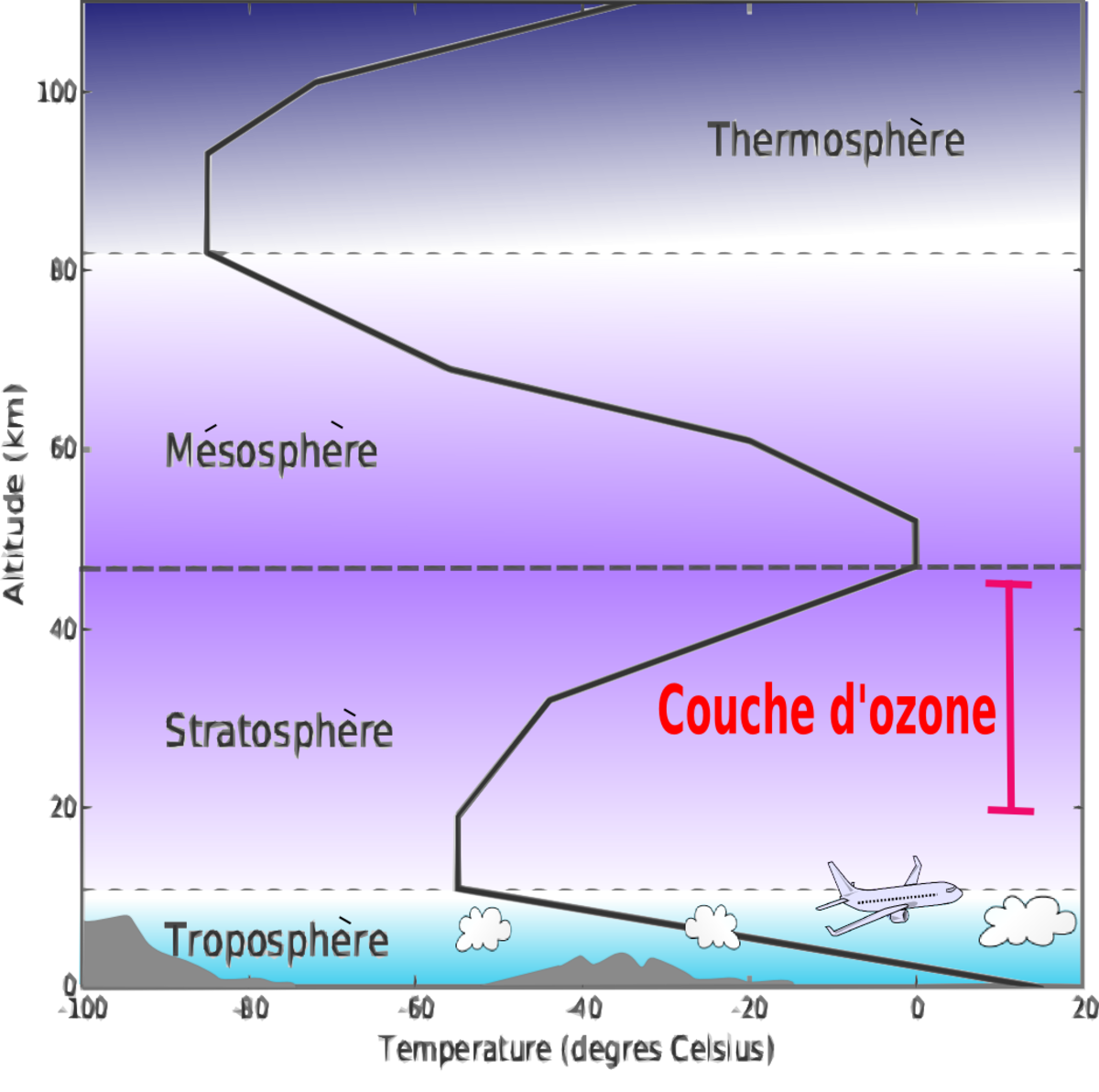
La couche d'ozone ou ozonosphère désigne la partie de la stratosphère contenant une quantité relativement importante d'ozone (concentration de l'ordre de un pour cent mille). Son existence est démontrée en 1913 par Henri Buisson et Charles Fabry grâce à son interféromètre optique. Cet ozone est produit par l'action du rayonnement solaire sur les molécules de dioxygène à haute altitude (entre 20 et 50 km d'altitude).
À cette haute altitude, la couche d'ozone a pour effet d'absorber la plus grande partie du rayonnement solaire ultraviolet, qui se trouve être dangereux pour les organismes vivants.
On distingue, suivant le lieu et non la composition :
- le « bon ozone » présent dans la couche stratosphérique (objet de cet article), bon car il nous protège des rayons UV-C (ultraviolet) ;
- le « mauvais ozone » présent dès la couche basse de l'atmosphère (troposphère : du sol jusqu'à environ 20 km d'altitude), « mauvais » car c'est celui que nous respirons et qui présente selon sa concentration une certaine toxicité (voir Normes de qualité de l'air).
En l'absence de cette couche d'ozone, la vie n'aurait été possible que dans les océans, à une profondeur suffisante de la surface des eaux (les UV ne pénétrant qu'en surface). Ce fut le cas au cours de l'éon Archéen, lorsque l'atmosphère de la Terre était dépourvue de dioxygène (et donc d'ozone).
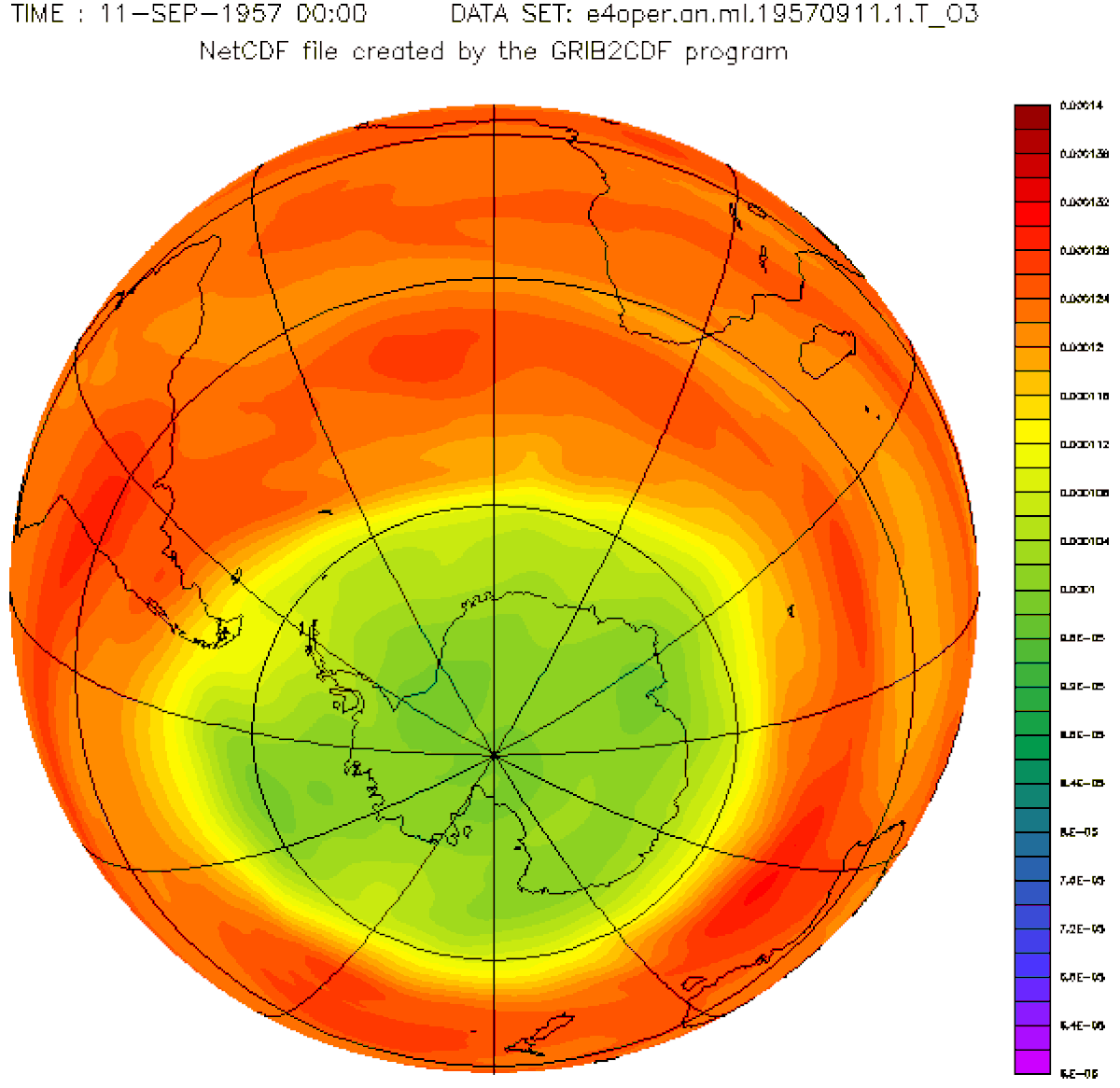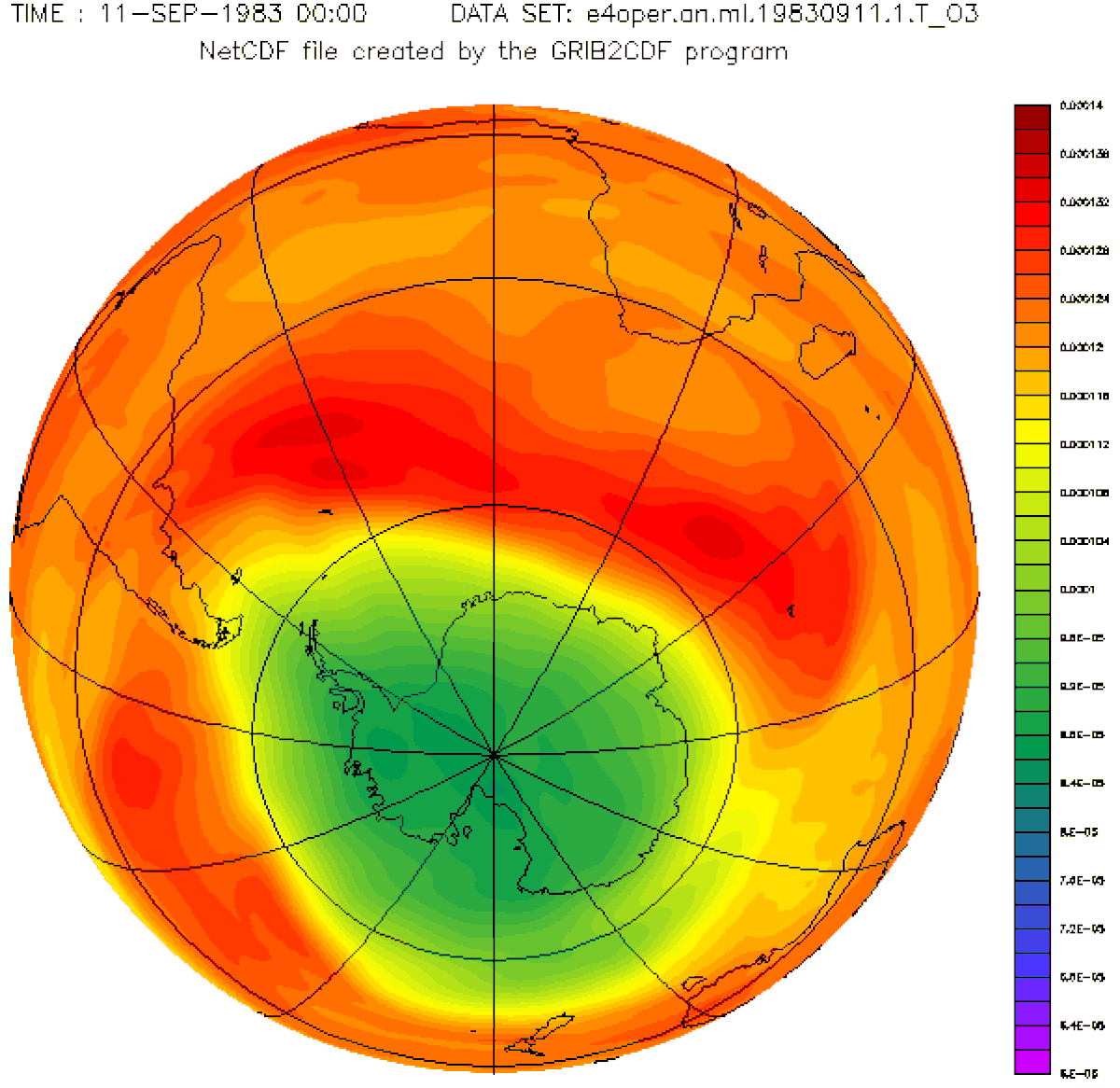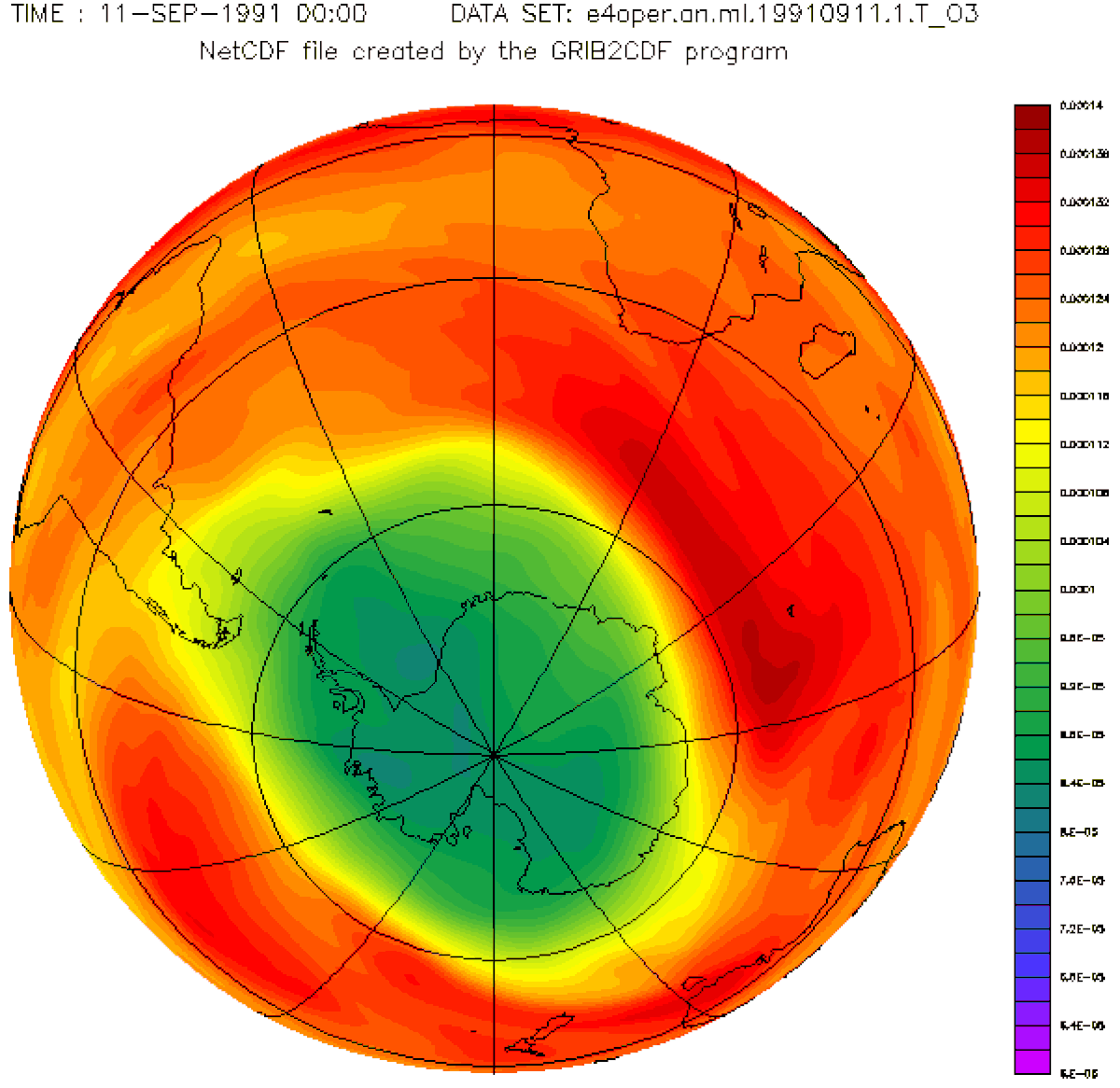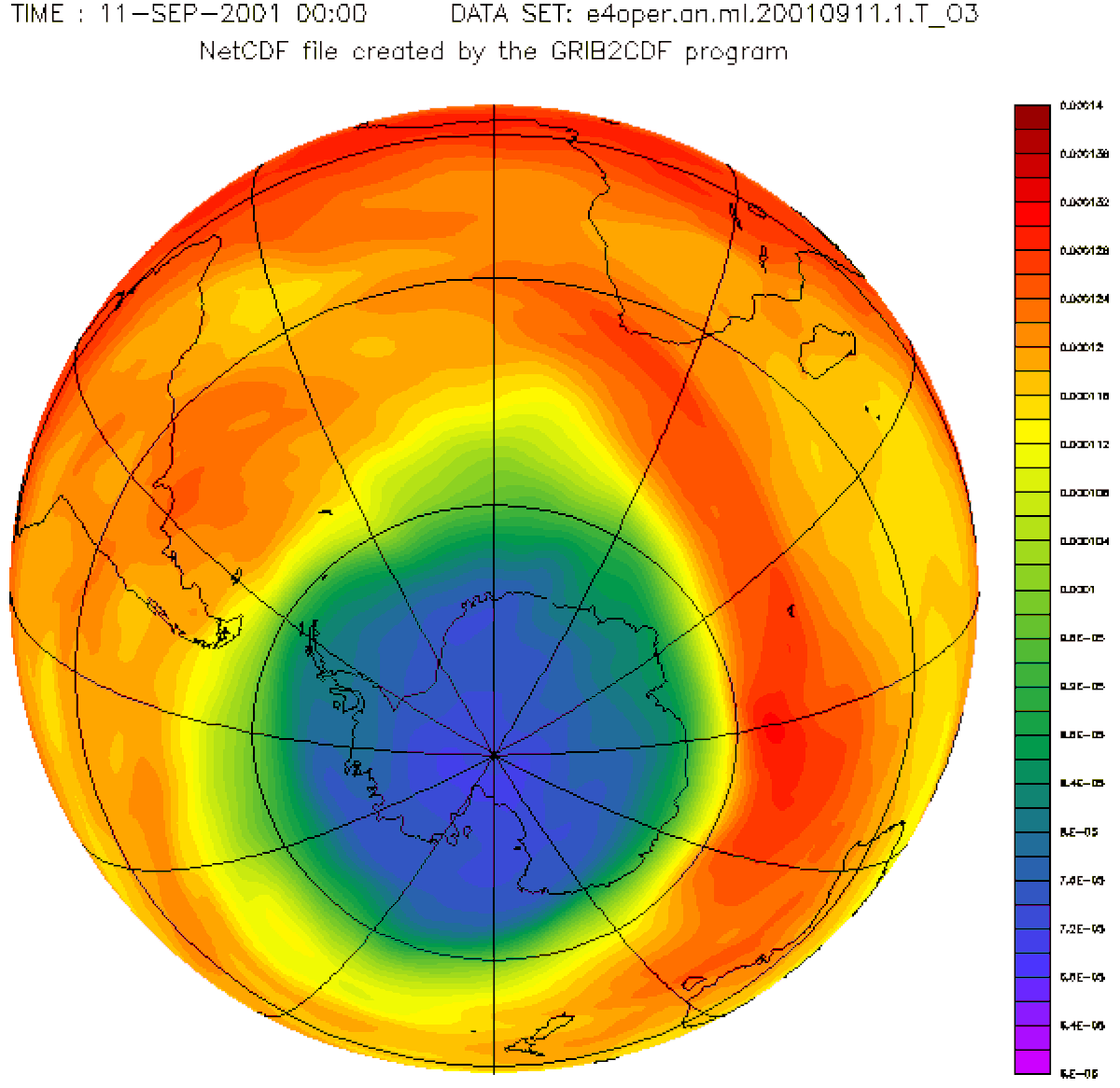
À la fin des années 1970, des recherches scientifiques en Antarctique ont mis en évidence une diminution périodique de l'ozone dans cette région polaire. Ce que l'on a appelé le « trou de la couche d'ozone ». Il se forme au printemps dans l'Antarctique (à la fin de la nuit polaire) et s'agrandit pendant plusieurs mois avant de se réduire.
L'ozone stratosphérique
Cet ozone stratosphérique qui s'étend entre 20 et 50 km d'altitude, est en réalité très dilué dans l'atmosphère locale. De l'ordre de quelques ppm à quelques dizaines de ppm dans la couche d'ozone elle-même, qui est un mélange gazeux à faible pression.
En fait, si cet ozone était regroupé, concentré à l'état pur, il aurait dans les conditions normales de température et de pression (c'est-à-dire les conditions moyennes à la surface de la Terre) une épaisseur de seulement 3 mm, soit 300 unités Dobson (DU). On remarquera que c'est cette couche d'ozone si ténue qui protège la vie des rayons ultraviolets.
Processus de formation

L'ozone est produit à partir du dioxygène, composé de deux atomes d'oxygène.
Aux altitudes supérieures à 30 km, le rayonnement solaire possède encore une énergie suffisante pour casser une partie des molécules de dioxygène et libérer les atomes. Un atome d'oxygène tendant à ne pas rester seul pour des raisons de stabilité, doit se recombiner à un autre élément ; il interagit donc avec une autre molécule de dioxygène (O2) présente pour former une nouvelle molécule, composée de trois atomes d'oxygène : l'ozone (O3).
-
- O2 + rayonnement solaire → O + O et O + O2 → O3
Cette réaction chimique est la seule qui, dans la stratosphère, produise de l'ozone.
Mais puisque tout l'oxygène n'est pas transformé en ozone dans ce processus, il existe donc un facteur limitant sa concentration. Primitivement, une certaine quantité d'ozone est apparue, il y a plus de 2 milliards d'années, lorsque l'oxygène est devenu permanent avec une concentration de l'ordre du pourcent. La concentration observée aujourd'hui résulte d'un équilibre entre la production d'ozone par le rayonnement solaire, et certains processus de destruction : tout l'ozone produit en « trop plein du réservoir » est détruit. C'est ce que l'on appelle un équilibre dynamique.
D'autres études, menées à l'aide de ballons évoluant à haute altitude et de satellites météorologiques, ont révélé que la proportion d'ozone au-dessus de l'Antarctique est en baisse. Des vols au-dessus de l'Arctique ont mis en évidence des problèmes similaires dans cette région.
Un équilibre dynamique
Le jour, à haute altitude, le rayonnement solaire peut dissocier la molécule d'ozone en une molécule de dioxygène et un atome d'oxygène :
-
- O3 + rayonnement → O2 + O
Durant la nuit et en particulier la nuit polaire, cette réaction n'existe pas puisqu'il n'y a plus de rayonnement solaire. Une autre réaction devient alors prépondérante : la recombinaison d'un atome d'oxygène et d'une molécule d'ozone pour donner deux molécules de dioxygène :
-
- O3 + O → 2 O2
Mais l'ensemble de ces deux réactions ne peut rendre compte que de 20 % de la destruction naturelle de l'ozone, alors que pour parvenir à un équilibre il faut que la perte soit égale à la production. Ce problème met en évidence la fragilité de l'équilibre de l'ozone. En effet, si les deux réactions ci-dessus avaient pu suffire à compenser la surproduction d'ozone, l'équilibre de ce dernier ne dépendrait que de la quantité de dioxygène présent dans la haute atmosphère, et cet équilibre aurait été difficilement perturbable, mais les composés chlorés perturbent cet équilibre. Les composés bromés, et les oxydes d'azotes (NOx) contribuent également à cette destruction.
L'action des composés chlorés
Parvenues dans la stratosphère, les molécules de composés chlorés sont décomposées par le rayonnement solaire, les produits de cette décomposition détruisant les molécules d'ozone par le jeu de réactions catalytiques.
Les sources naturelles de chlore
La seule source naturelle de chlore est le chlorure de méthyle, principalement produit dans les océans par les micro-organismes, les algues. La concentration ne dépasse pas 0,6 milliardième : c'est à cela que se limite le fond naturel de chlore dans l'atmosphère.
Les chlorofluorocarbures
Inventés dans les années 1930, les chlorofluorocarbures ont connu un développement important à partir des années 1950 à cause de leurs propriétés remarquables (ininflammables, facilement compressibles, non solubles) et, comme ils n'ont qu'une faible réactivité chimique, on les croyait peu toxiques pour l'environnement. Utilisés principalement dans l'industrie du froid, dans les bombes aérosols comme propulseur, en solvants pour l'industrie électronique, dans les mousses synthétiques et les agents extincteurs ; ils sont essentiellement dus à l'activité humaine.
La production des CFC est très importante. Pour les deux principaux, le trichlorofluorométhane (CFC 11) et le dichlorofluorométhane (R 21), la production est passée de 50 000 à 100 000 t au début des années 1960 jusqu'à 500 000 t en 1999. Cela représente une croissance de 5 à 6 % par an, soit pratiquement un doublement de la quantité tous les dix ans.
Diffusion dans la basse atmosphère
Les vents brassent l'atmosphère en permanence :
- Horizontalement, avec un temps moyen de transport d'un pôle à l'autre de l'ordre de 2 ou 3 ans.
- Verticalement, avec une homogénéisation de l'atmosphère jusqu'à 80 km d'altitude.
En 2 à 3 ans, les CFC se retrouvent donc dans l'atmosphère sous toutes les latitudes, aussi bien à l'équateur qu'aux pôles. Puis, en 15 ans, ils montent dans la haute atmosphère.
Accumulation dans la stratosphère
À cela s'ajoute un autre effet, les CFC présents dans la stratosphère en 1997 sont ceux qui ont été produits entre 1977 et 1982, ce qui ne représente que 40 % de ce qui a été produit jusqu'à ce jour.
Les 60 % restants sont encore en train de se mélanger et de monter. Du fait de ce retard, les effets des CFC produits ces dernières années se feront encore sentir dans 60 ans.
Bilan
Ainsi, la quantité de chlore naturellement présente dans la stratosphère est d'environ 0,6 milliardième, alors qu'aujourd'hui la proportion totale de chlore atteint 3,5 milliardièmes. Elle a été multipliée par 5 en 20 ans, ce qui a entrainé une rupture de l'équilibre dynamique.
En hiver, la destruction d'ozone est nulle. Au printemps, elle est très importante car il y a déjà des UV, beaucoup de cristaux de glace dans la stratosphère et parce que la circulation atmosphérique, le vortex polaire autour de l'Antarctique, empêche le remplacement de l'ozone détruit.
Dès la fin du printemps, l'amincissement est moins important parce que la quantité de cristaux de glace diminue, et aussi parce que la circulation atmosphérique change : il y a alors un mélange entre l'air antarctique et l'air venu du nord qui apporte de l'ozone.