Fluorine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| | |
|---|---|
| | |
| | |
| Catégorie | Minéral |
| Formule brute | CaF |
| | |
| Masse moléculaire | 78,07 g/mol |
| Couleur | incolore, vert, rose, violet, bleu... |
| Classe cristalline ou groupe d'espace | Hexakisoctaédrique - m3m |
| Système cristallin | cubique |
| Réseau de Bravais | Faces centrées F |
| Macle | Par pénétration sur {111} |
| Clivage | {111} parfait |
| Habitus | Cubique, octaédrique, dodécaédrique, massif, grenu, grossier, fin, botryoïdal, fibreux, hexaédrique, concretionnaire… |
| Fracture | conchoïdale ; esquilleuse ; irrégulière |
| Échelle de Mohs | 4 |
| Éclat | vitreux |
| | |
| Indice de réfraction | n=1,433-1,435 |
| Biréfringence | nulle |
| Dispersion | 2vz ~ 0,007 |
| Polychroïsme | Nul |
| Fluorescence ultraviolet | oui |
| Trait | blanc |
| Transparence | transparent à translucide |
| | |
| Densité | 3,18 |
| Solubilité | Soluble dans HCl + borate ou AlCl pour complexer le ions F+, dans H2SO4 concentré chaud (dégage du F), |
| | |
| Radioactivité | aucune |
| | |
| Fluorine | |
|---|---|
| Général | |
| Nom IUPAC | |
| No CAS | |
| No EINECS | |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores ou poudre blanche, hygroscopique. |
| Propriétés chimiques | |
| Formule brute | CaF2 |
| Masse molaire | 78,075 ± 0,004 g·mol-1 |
| Propriétés physiques | |
| T° fusion | 1 403 °C |
| T° ébullition | 2 500 °C |
| Masse volumique | 3,2 g·cm-3 |
| | |
La fluorite est une espèce minérale composée de fluorure de calcium, de formule idéale CaF avec des traces : Y;Ce;Si;Al;Fe;Mg;Eu;Sm;O;ORG;Cl;TR. Ces différents ions expliquent les multiples couleurs et zonations colorées rencontrées pour ce minéral. La fluorite peut présenter les phénomènes de fluorescence, triboluminescence et thermoluminescence.
À noter que le terme francophone est fluorine (Cf. Synonymie).
Inventeur et étymologie
Connu depuis l'antiquité, c'est la description de Georgius Agricola en 1529 qui fait référence. Le terme « fluorite » est du naturaliste Napione. Son nom vient du latin fluere qui veut dire fondant (qui coule).
Cristallographie
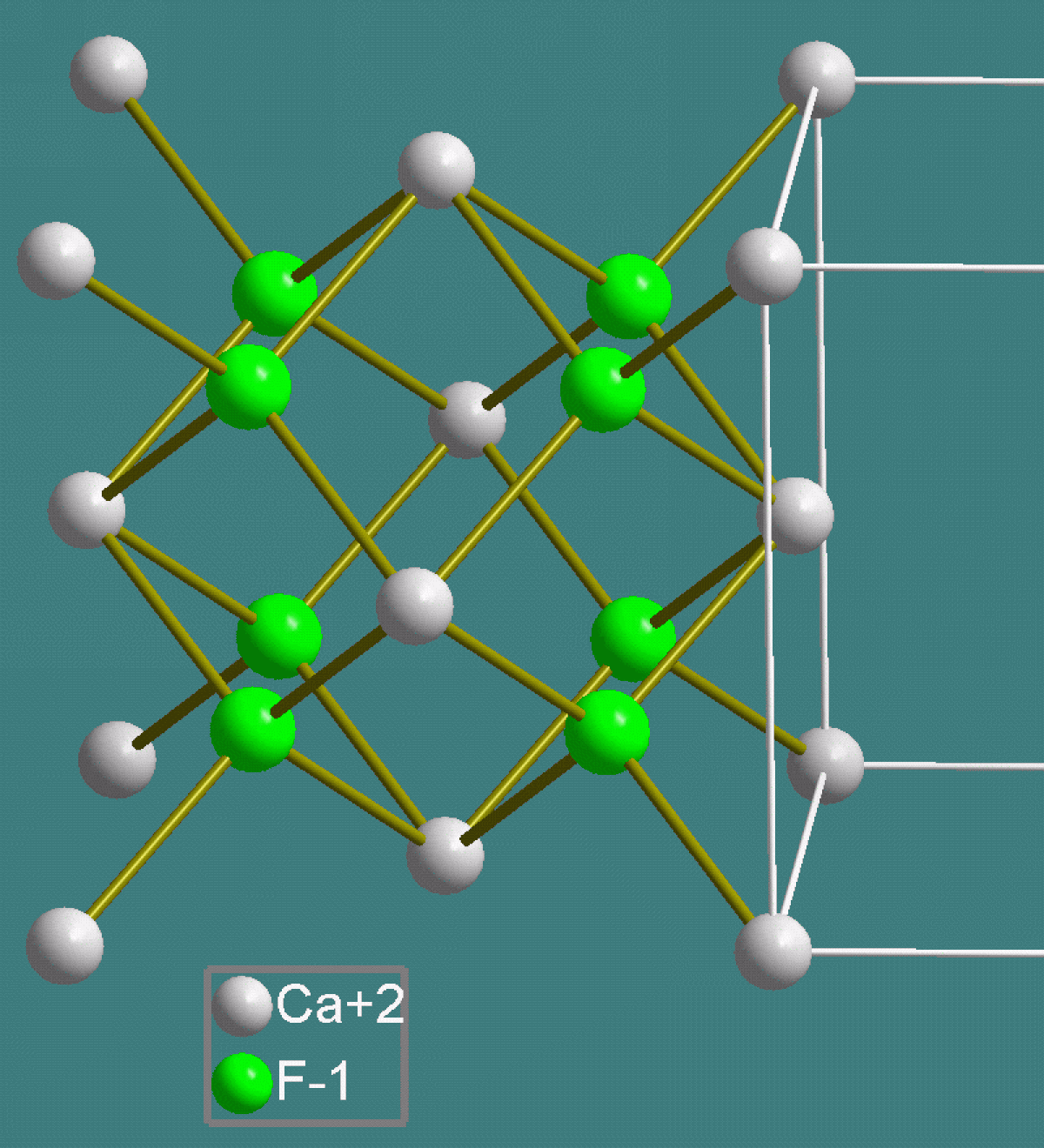
| Structure de la fluorite. Gris : calcium, vert : fluor. |
La fluorite est un assemblage d'ions Ca2+ et F–. Les anions F– sont deux fois plus nombreux que les cations Ca2+.
La fluorite cristallise dans le groupe d'espace cubique Fm3m (Z = 4) :
- paramètre de la maille conventionnelle : a = 5,463 Å ; V = 163,03 Å3 ;
- densité calculée = 3,18 g/cm3
La structure de la fluorine correspond à un remplissage d'une structure hôte. Les anions F– forment un réseau cubique simple dans lequel les cations Ca2+ occupent la moitié des sites cubiques. Les cations et les anions ont à peu près la même taille. Il est aussi possible d'inverser les rôles des cations et des anions et de considérer que les cations Ca2+ forment un réseau hôte cubique à faces centrées et les anions F– occupent tous les sites tétraédriques. Ces deux visions sont équivalentes. La structure de la fluorite peut être assimilée à deux sous-réseaux : les cations Ca+ forment un sous-réseau cubique à faces centrées et les anions F– forment un sous-réseau cubique primitif.
Dans la structure de la fluorite :
- la coordinence des cations Ca2+ est de 8 : cubes CaF ;
- la coordinence des anions F– est de 4 : tétraèdres FCa.