Quinine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Quinine | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
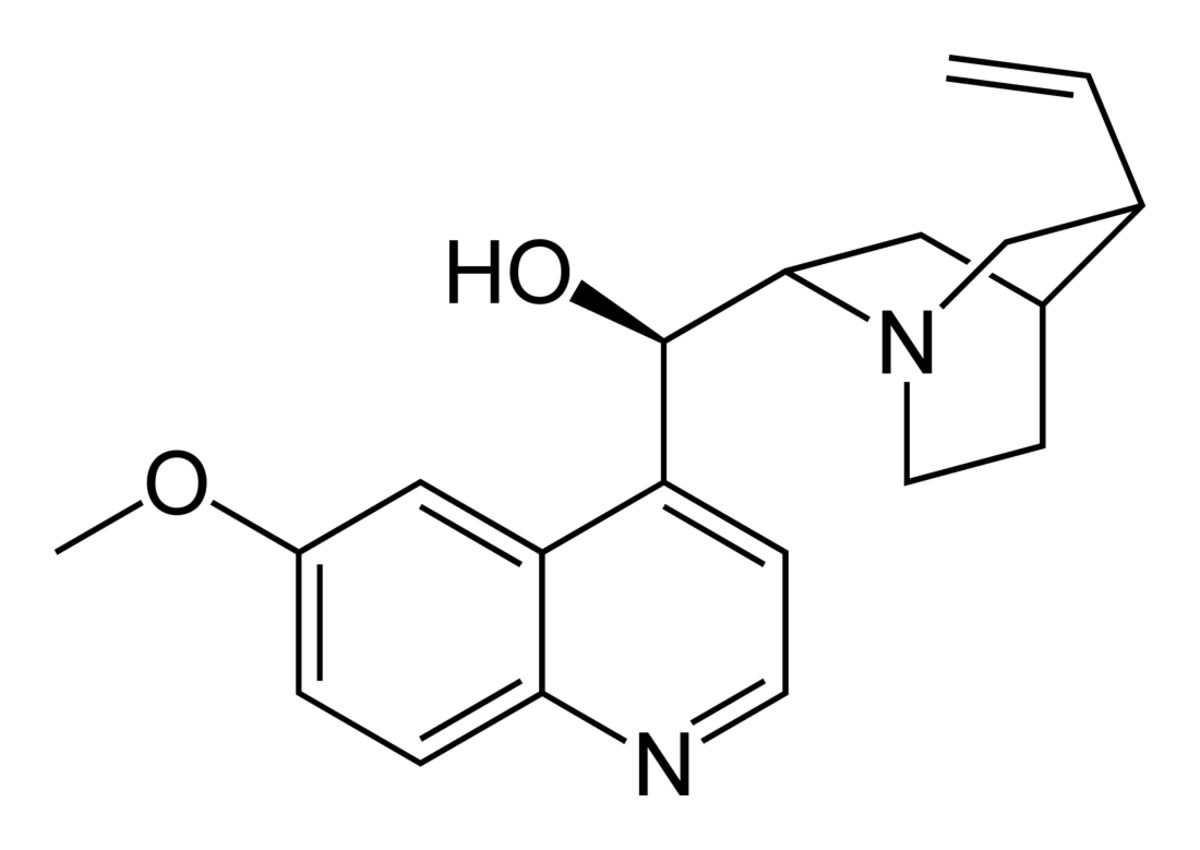
| Synonymes | (R)-(5-ethenyl-1-azabicyclo[2.2.2]oct-2-yl)-(6-methoxyquinolin-4-yl)-methanol | |
| No CAS | ||
| No EINECS | ||
| Code ATC | M09 P01 | |
| DrugBank | ||
| PubChem | ||
| SMILES | ||
| InChI | ||
| Apparence | aiguilles orthorhombiques | |
| Propriétés chimiques | ||
| Formule brute | C20H24N2O2 | |
| Masse molaire | 324,4168 ± 0,0187 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 177 °C (décomposition partielle) ; Trihydrate : fusion à 57 °C et déshydratation à 125 °C. | |
| Solubilité | 500 mg·l-1 eau à 15 °C. 1 g /1,9 L eau. 1 g /0,76 L eau bouillante. 1 g / 0,8 mL éthanol. 1 g / 80 mL benzène. 1 g /1,2 mL chloroforme. 1 g /250 mL éther sec. 1 g / 20 mL glycérol. 1 g /1,9 L ammoniaque à 10 %. | |
| Pression de vapeur saturante | 1,1×10-10 mmHg à 25 °C | |
| Précautions | ||
| | ||
| ||
| Phrases R : 36/37/38, 42/43, | ||
| Phrases S : 22, 26, 36/37, 45, | ||
| Classe thérapeutique | ||
| antipyrétique, antipaludique, analgésique | ||
| Données pharmacocinétiques | ||
| Biodisponibilité | 76 à 88 % | |
| Métabolisme | Hépatique | |
| Demi-vie d’élim. | ≈18 heures | |
| Excrétion | Rénal (20 %) | |
| Considérations thérapeutiques | ||
| Voie d’administration | Oral, Perfusion | |
| | ||
La quinine est un alcaloïde naturel qui est antipyrétique, analgésique et, surtout, antipaludique . Elle était utilisée pour la prévention du paludisme avant d'être supplantée par ses dérivés, quinacrine, chloroquine, et primaquine.
Histoire de la découverte de la quinine
Les quinquinas sont des arbres de la Cordillère des Andes poussant en haute altitude. L'écorce de quinquina était connue, et ce dès le XVIIe siècle, pour guérir la fièvre tierce. Des jésuites de Lima rapportèrent son usage à Rome pour soulager les fièvres intermittentes qui faisaient rage tous les étés dans cette ville. Ils la popularisèrent ensuite en Europe. D'où son nom d'Herbe des Jésuites ou encore écorce du Pérou.
Ce n'est qu'en 1820 que les chimistes français Pierre Pelletier et Joseph Caventou purent extraire les principes actifs de l'écorce du quinquina. Ils découvrirent que la base fébrifuge était constituée de deux alcaloïdes qu'ils appelèrent quinine et cinchonine.
Les deux chimistes, en raison de leur formation de pharmaciens, étaient soucieux de tirer des applications pharmacologiques de leur découverte. Ils se lancèrent donc dans la fabrication de la quinine. Leur atelier de fabrication put traiter, en 1826, 160 tonnes d'écorce de quinquina pour extraire 1800 kilos de sulfate de quinine. En rendant publique leur invention, ils permirent à qui le voulait d'en tirer parti. Ce fut le cas de plusieurs entrepreneurs allemands qui se lancèrent aussi dans l'extraction à grande échelle de la quinine, marquant ainsi les débuts de la grande industrie pharmaceutique.
Ces recherches ont permis d'étudier à quelles doses les principes actifs étaient efficaces. Pelletier avait envoyé ses alcaloïdes à François Magendie pour qu'il les teste sur l'animal et sur l'homme. Magendie remarqua :
La production de quinine marque ainsi le début du remplacement des plantes médicinales au contenu variable, incertain et parfois frelaté, par des médicaments faciles à prendre et ne contenant que la molécule active, à une dose précise.
La structure chimique de la quinine ne fut décrite qu'un siècle plus tard et confirmée en 1944 par sa synthèse réalisée par Robert Woodward et William von Eggers Doering de l'Université d'Harvard.



















































