Argent - Définition
La liste des auteurs de cet article est disponible ici.
Science
Etat dans la nature
L'argent est peu présent dans l'eau, mais on en trouve une très faible proportion dans la mer (0.001 ppm en moyenne, avec des concentrations plus élevées aux embouchures des fleuves).
À échelle nanométrique, le nano-argent a des propriétés particulières, biocides notamment.
On le trouve dans des minéraux tels que l'argentite (Ag2S) ou la cérargyrite (AgCl). Il peut aussi être associé à l'arsenic, l'antimoine, le cuivre, l'or, le plomb ou le zinc.
Propriétés physico-chimiques
L’argent est un métal relativement ductile et très malléable, apprécié pour son éclat blanc particulier.
Il est attaqué par les sulfures contenus dans les aliments, d'où le noircissement de la vaisselle en argent qu'on observe parfois.
Les sulfures présents dans l'atmosphère réagissent avec l'argent pour former Ag2S. Le ternissement est accéléré par la présence de cuivre dans les alliages. On peut éviter le ternissement en le stockant avec du papier imprégné d'acétate de cuivre ou de cadmium, qui ont plus d'affinité pour H2S. Traiter l'argent par électrolyse avec une solution de chromate alcalin retarde le ternissement.
La corructation est une lumière vive, ponctuelle, émise par ce métal au moment de son refroidissement après fusion lorsque le voile composé d’oxydes et de fondant en surface se déchire emportés par le borax. Cette solidification appelée rochage par absorption de l’oxygène fait gonfler le métal.
Solubilité
L'acide de choix pour dissoudre l'argent est l'acide nitrique :
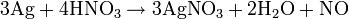
La dissolution dans l'acide sulfurique concentré chaud est plus économique en acide :
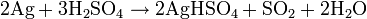
ou :
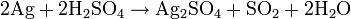
L'argent est attaqué par l'eau régale, l'acide chromique, les solutions de permanganate, l'acide persulfurique, l'acide sélénique et les solutions aqueuses d'halogènes libres. Les réactions peuvent être ralenties par la formation d'une couche protectrice (AgCl par exemple).
Il est également soluble dans les hydroxydes alcalins fondus en présence d'air et dans les peroxydes fondus.
Analyse
On peut analyser un échantillon en le dissolvant dans de l'acide nitrique et en précipitant l'argent sous forme d'AgCl. Le seuil de détection est de 0,1 µg/L. Contrairement aux autres chlorures peu solubles, le chlorure d'argent est soluble dans l'ammoniaque.
Les halogénures d'argent peuvent être dissous dans NaKCO3 fondu. L'argent est précipité sous forme métallique et peut être séparé par dissolution dans l'eau.
Alliages notables
- L'électrum, alliage naturel d'or et d'argent.
- L'argent Britannia, un alliage dont la composition massique est à 95,84% d'argent et à 4,16% d'autre métal, généralement du cuivre. Le titre au millième de l'argent Britannia est de 958.
- L'argent sterling (aussi appelé argent fin et argent premier titre) est un alliage dont la composition massique est à 92,5% d'argent et à 7,5% d'autre métal, généralement du cuivre. Le titre au millième de l'argent sterling est au minimum de 925.
Toxicologie, écotoxicologie
L'argent est très toxique pour les bactéries, les champignons et de nombreux organismes à sang froid. L’argent est extrêmement toxique pour les larves de mollusques alors que les adultes peuvent le bioaccumuler en quantité importante.
Pour des raisons mal comprises, l'être humain en supporte des doses bien plus élevées que ces organismes; L'absorption d'argent dans la circulation du sang de l’organisme humain ne semble pas avoir d’effet direct en deça d'un certain seuil, mais un excès provoque une maladie dite argyrisme qui donne à la peau et au blanc de l'œil un teint gris-bleuâtre, voire noirâtre.
Au-delà de 0,4 ng/litre l'argent est considéré comme un indicateur de pollution (par le nitrate d'argent par exemple).
Des baies très polluées comme la Baie de San Francisco et celle de Caroline du Sud en contiennent jusqu'à 20 ng/litre voir plus. Les organismes marins filtreurs peuvent alors en accumuler des doses préoccupantes (ex : 0,01 à 58 mg·kg-1 de chair, en poids sec, relevé dans des moules aux USA, ou 1,8 à 11 mg·kg-1 dans des huitres (p.s.)). L'argent pourrait ainsi contribuer à certains déséquilibres écologiques et au phénomène de zones marines mortes qui caractérise certaines baies.

















































