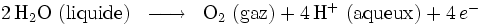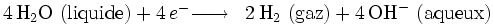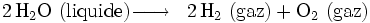Électrolyse - Définition
La liste des auteurs de cet article est disponible ici.
Applications
Production de dihydrogène par électrolyse de l'eau
L'électrolyse peut être utilisée pour décomposer l'eau (HO) en dihydrogène (H) et en dioxygène (O).
Réactions :
- Oxydation à l'anode (reliée au pôle + du générateur) :
- Réduction à la cathode (reliée au pôle - du générateur) :
- Globalement, nous avons :
Néanmoins, si cette méthode est efficace (rendement Faraday de 90 % en solution alcaline), elle n'est pas la moins chère pour produire du dioxygène et du dihydrogène industriellement. On préfère souvent extraire le dioxygène de l'air, et le dihydrogène par reformage du méthane : CH. Mais contrairement à l'électrolyse, cette méthode produit également du CO (voir l'article dihydrogène)
Remarque : lorsque de l'eau est électrolysée, l'eau lourde (contenant l'isotope lourd deutérium à la place de 1H) a tendance à se dissocier en fin d'électrolyse, puisque la liaison D-O est légèrement plus forte que le liaison 1H-O de l'eau légère (eau "normale" 1HO).
Production de chlore
Le dichlore est un gaz jaunâtre toxique. On utilise actuellement des électrolyseurs qui utilisent l'électrolyse d'une solution aqueuse de NaCl pour produire des ions hypochlorites à l'usage du traitement de l'eau des piscines.
Plaquage
La technique du plaquage par électrolyse consiste à recouvrir des objets d'une mince couche régulière d'un métal généralement précieux ou d'un alliage: dorure, argenture, nickelage, chromage, cadmiage, cuivrage...
Par exemple, une bague est plongée dans une solution de chlorure d'argent (Ag+ + Cl-) reliée à un générateur.
Les ions d'argent vont se déposer sur l'anneau selon la réaction d'oxydo-réduction : Ag+ + e- → Ag. On obtient ainsi un anneau plaqué argent, cette technique s'appelle l'argenture.
Plus généralement, les dérivés chimiques d'un métal donné peuvent être utilisés à des fins de placage avec ce dernier. Ainsi, on peut couvrir un objet métallique de cuivre avec le bain de sulfate de cuivre qu'on utilise d'ordinaire pour traiter la vigne.
On peut tester avec l'expérience suivante avec:
- Une source de courant continu réglable, capable de délivrer de 1 à 10 ampères.
- Un récipient pour le bain (ne doit pas être métallique).
La cathode (-) est reliée à la pièce à plaquer, l'anode (+) est reliée à un morceau de cuivre qui servira à alimenter le placage. Les deux électrodes sont plongées dans le bain, à quelques centimètres l'une de l'autre et, on fait passer le courant autant de temps que nécessaire.
Facteurs favorisant le phénomène :
- Concentration du bain : Plus le bain est concentré, plus le placage est rapide.
- Surface de la pièce à plaquer : plus la surface de la pièce est grande, plus l'intensité électrique doit être élevée.
- La vitesse du dépôt : elle est proportionnelle à la quantité de courant traversant la pièce à plaquer.
- La température : la chaleur favorise le rendement du bain.
Le chromage de pièce en acier se déroule ainsi :
- La pièce métallique constituant la CATHODE est plongée avec une ANODE en chrome dans une solution (l'ELECTROLYTE) contenant des ions de chrome (Cr3+) ;
- Le générateur positionné entre l'anode et la cathode délivre un courant continu ;
- La pièce métallique gagne des électrons et attire les ions de chrome qui adhérent à sa surface.
Production de cuivre et d'aluminium
L’aluminium primaire est obtenu par électrolyse de l’alumine .Le procédé consiste à réduire par électrolyse de l’alumine dissoute dans un bain de cryolithe (fluorure double d’aluminium et de sodium – AlF, 3NaF) fondue à environ 950 °C, dans une cuve traversée par un courant électrique de haute intensité. Soumis à l’action du courant électrique continu, les ions sont transportés aux deux électrodes.
L’électrode positive attire les ions négatifs, l’oxygène (O--). L’anode est placée en haut du creuset où s’effectue l’électrolyse ; l’oxygène peut ainsi se dégager sous forme de CO gazeux, après avoir brûlé le carbone qui constitue l’anode.
L’électrode négative, attire les ions positifs, l’aluminium (Al+++). La cathode est située au fond du creuset où l’aluminium plus lourd que le bain se dépose et reste sous forme d’une couche de métal liquide à haute température. Ce métal liquide est régulièrement aspiré et transporté en fonderie, pour être solidifié sous forme de demi-produit ( lingot, billette, plaque de laminage ).
Le phénomène global se traduit par la réaction : 2 AlO + 3 C = 4 Al + 3CO
L'affinage industriel du cuivre brut s'effectue par électrolyse d'anodes de cuivre brut dans un bain de sulfate de cuivre. Le cuivre pur ( jusqu'à 99,95 %) se fixe sur la cathode, les impuretés restant dans le bain.