Éthylène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Éthylène | |||||
|---|---|---|---|---|---|
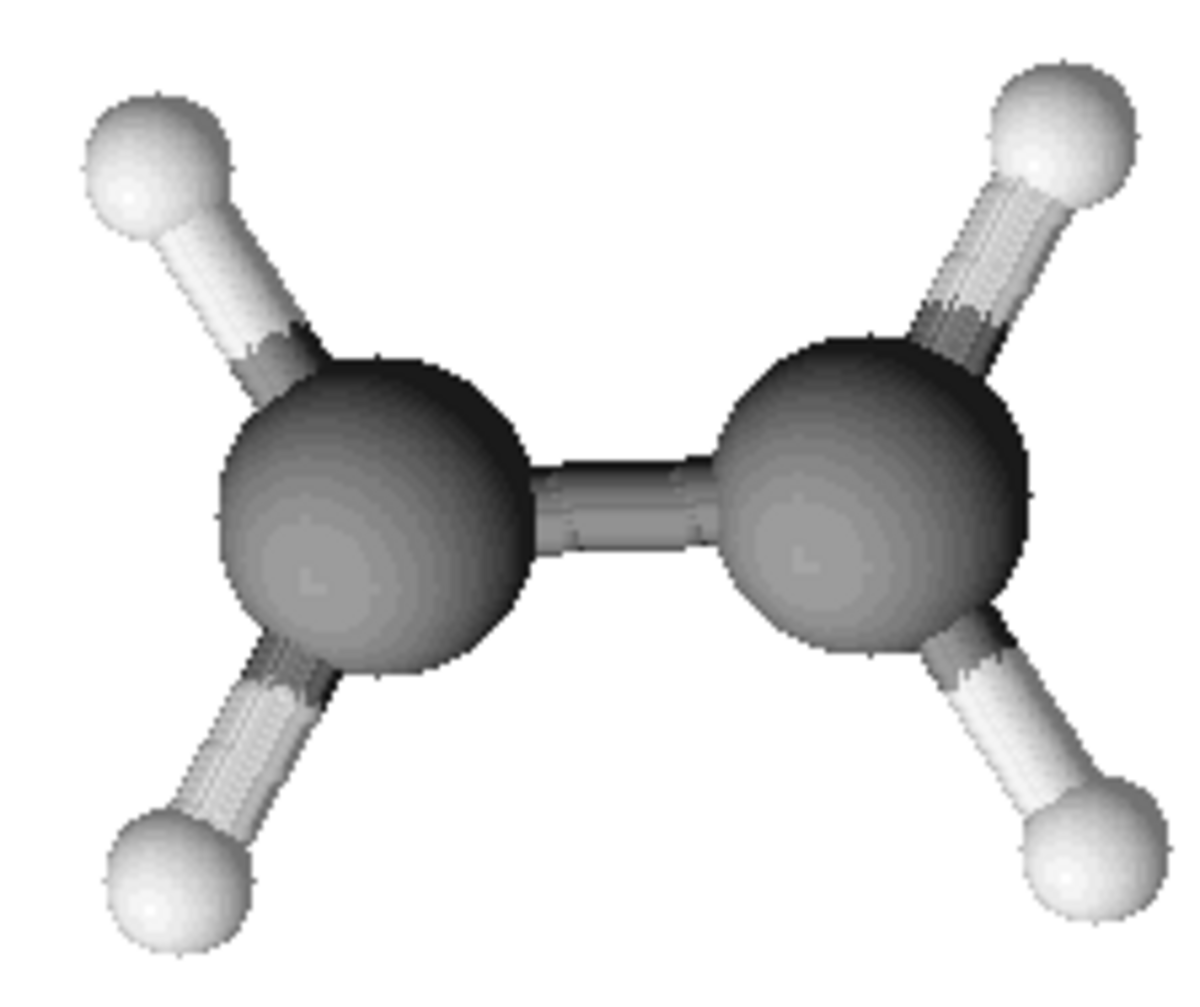
| |||||
| Général | |||||
| Synonymes | éthène | ||||
| No CAS | |||||
| No EINECS | |||||
| SMILES | |||||
| InChI | |||||
| Apparence | gaz comprimé incolore, d'odeur caractéristique. | ||||
| Propriétés chimiques | |||||
| Formule brute | C2H4 | ||||
| Masse molaire | 28,0532 ± 0,0019 g·mol-1 | ||||
| Propriétés physiques | |||||
| T° fusion | -169,2 °C | ||||
| T° ébullition | -103,9 °C | ||||
| Solubilité | dans l'eau : nulle | ||||
| Masse volumique | |||||
| T° d’auto-inflammation | 490 °C | ||||
| Point d’éclair | gaz inflammable | ||||
| Limites d’explosivité dans l’air | 2,7–36,0 %vol | ||||
| Pression de vapeur saturante | à 15 °C : 8 100 kPa | ||||
| Point critique | 5 060 kPa, 9,19 °C | ||||
| Thermochimie | |||||
| ΔH0 | 52,38 kJ·mol-1 | ||||
| Cp | |||||
| Propriétés électroniques | |||||
| 1re énergie d'ionisation | 10,5138 eV ± 0,0006 (gaz) | ||||
| Cristallographie | |||||
| Classe cristalline ou groupe d’espace | P21/n | ||||
| Paramètres de maille | a = 4,626 Å b = 6,620 Å | ||||
| Volume | 124,18 Å3 | ||||
| Densité théorique | 0,750 | ||||
| Précautions | |||||
| | |||||
| |||||
| Phrases R : 12, 67, | |||||
| Phrases S : (2), 9, 16, 33, 46, | |||||
| | |||||
| |||||
| | |||||



| |||||
| | |||||



Danger | |||||
| | |||||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||||
| Écotoxicologie | |||||
| Seuil de l’odorat | bas : 17 ppm haut : 959 ppm | ||||
| | |||||
L'éthylène ou correctement éthène, est un hydrocarbure insaturé. On peut aussi le trouver sous l'appellation R1150.
Chimie
Propriétés physiques
L'éthène (éthylène) est le plus simple des alcènes.
| brute : | C2H4 |
| semi-développée : | CH2=CH2 |
| développée : | 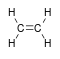
|
| représenté généralement par une double liaison : |
C'est un gaz incolore, volatile, de densité proche de l'air avec lequel il forme des mélanges explosifs. À partir de 425 °C, il s'enflamme et brûle avec une flamme claire.(chaleur de combustion: 47 200 kJ/kg).
Propriétés chimiques
C'est un gaz très réactif.
L'éthylène peut être hydraté en éthanol par addition d'une molécule d'eau en milieu acide.
H2C = CH2 + H2O ⇒ H3C - CH2OH
- halogénation
par halogénation, l'éthylène conduit au dibromoéthane.
H2C = CH2 + Br2 ⇒ BrH2C - CH2Br
- hydroxylation
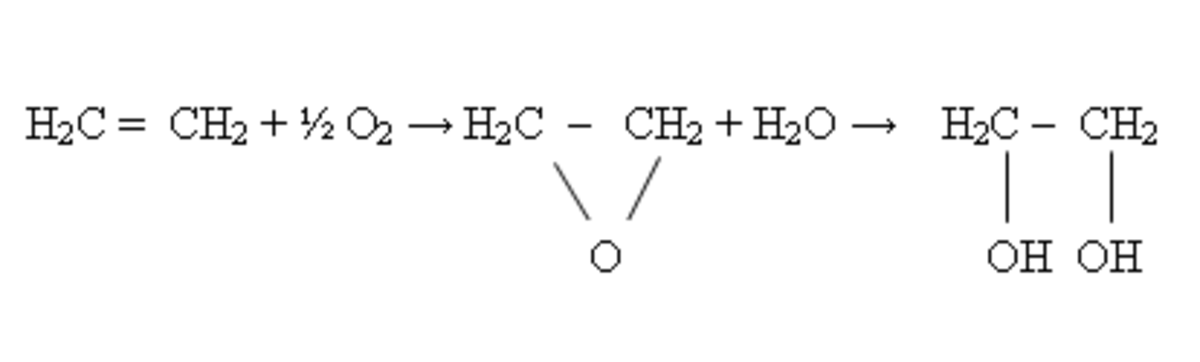
L'éthylène est hydroxylé en 1,2-éthanediol (glycol) en présence de catalyseurs.
La polymérisation de l'éthylène en polyéthylène s'effectue en présence d'un catalyseur par un processus radicalaire.
Production
Dans l'industrie pétrochimique, l'éthylène est obtenu:
- à partir de gaz naturel riche en éthane (USA) par pyrolyse ou craquage à température élevée: Dans ce procédé, la proportion d'éthylène dans le mélange gazeux résultant est environ 45%.
- à partir du naphta provenant de la distillation fractionnée du pétrole (Europe) par vapocraquage. La proportion d'éthylène dans le mélange obtenu est d'environ 25%.
Les sous-produits gazeux obtenus sont: le dihydrogène, le méthane, l'acétylène, l'éthane, le propadiène, le propène. Ces gaz sont ensuite séparés.
Utilisations
L'éthylène est à la base d'un grand nombre de molécules dans l'industrie chimique. Avec ses dérivés immédiats, il est à la source d'un grand nombre de polymères et de matières plastiques.
Les produits issus de l'éthylène sont entre autres : le chlorure de vinyle, l'éthylbenzène, l'oxyde d'éthylène, l'éthanol (ou alcool éthylique),
Le monomère peut être utilisé directement pour produire du polyéthylène.
Le chlorure de vinyle est polymérisé en polychlorure de vinyle (PVC), matière plastique bien connue, et l'une des plus anciennes.
L'éthylbenzène donne deux produits: du styrène et du caoutchouc SBR (Styrene-Butadiene-Rubber).
Le styrène est polymérisé en polystyrène, avec lequel on produit du polystyrène expansé ou des matières plastiques.
À partir du caoutchouc SBR, on obtient d'autres copolymères, comme le SBS (Styrene-Butadiene-Styrene).
L'oxyde d'éthylène ((CH2)2O) donne de l'éthylène-glycol, qui lui-même, combiné à l'acide téréphtalique, fournira des fibres polyesters.
L'éthanol peut être utilisé comme simple solvant.
L'oxyde d'éthylène ((CH2)2O) est un produit très instable à cause de «l'insaturation» de sa structure chimique. Il explose immédiatement en présence d'oxygène, c’est-à-dire qu'il cherche à combler le vide atomique de sa structure en captant les atomes d'oxygène de l'air. En 1957, un réacteur pilote d'oxyde d'éthylène a explosé à Anvers (Belgique), faisant plusieurs morts. Le souffle de l'explosion a déplacé un spectromètre de masse (de plus de cent tonnes) de plusieurs dizaines de mètres. L'éthylène-glycol sert également dans la fabrication des antigels.
Le PTFE (Poly-Tétra-Fluor-Ethylène), plus connu sous son nom commercial, le Téflon, est utilisé principalement comme joint d'étanchéité grâce à ses propriétés hydrophobes.