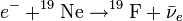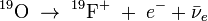Fluor - Définition
La liste des auteurs de cet article est disponible ici.
Préparation
Le difluor, F2, est aujourd’hui encore produit industriellement grâce au procédé d’électrolyse introduit par Henri Moissan en 1886. Le bain électrolytique est constitué d’un mélange KF-2HF fondu à 90 °C - 100 °C environ. Le HF anhydre n’est pas conducteur car peu dissocié et c’est l’ajout de KHF2 qui permet la conduction ionique par un mécanisme complexe.
Lors de la réaction d’électrolyse, le difluor est produit sur une anode en carbone selon :
2 HF2- → F2(g) + 2 HF + 2 e-
A la cathode (en métal), du dihydrogène est produit :
4 HF + 2 e- → H2(g) + 2 HF2-
Dans la cellule d’électrolyse, le potentiel appliqué est compris entre 8 et 10 V, et la densité de courant est de l’ordre de 12 A⋅dm-2. Le rendement en courant est bon (95 %), mais le rendement énergétique global n’est que de 30 %.
En 1986, à l’occasion du centième anniversaire de la découverte de la préparation électrochimique du fluor, Karl Christe a découvert une méthode originale et purement chimique de préparation en faisant réagir à 150 °C de l’acide fluorhydrique anhydre HF avec K2MnF6 et SbF5. La réaction est :
K2MnF6 + 2 SbF5 → 2 KSbF6 + MnF3 + 1/2 F2
Ce procédé est anecdotique car inexploitable industriellement.
Propriétés physiques
Le fluor est le premier élément de la colonne des halogènes. C'est un gaz jaune verdâtre inflammable d'une odeur piquante et irritante. C'est un élément très actif chimiquement, rarement monoatomique.
Un atome de fluor possède 9 électrons qui gravitent autour du noyau, sa configuration électronique peut s'écrire 1s2 2s2 2p5 ou [He](2s)2(2p)6. Sa structure électronique s'écrit (K)2(L)7. Pour que le fluor respecte la règle de l'octet, il gagne un dixième électron en formant l'ion fluorure F- pour avoir 8 électrons sur sa couche externe.
La première densité du fluor a été calculée par Henri Moissan à partir d'un expérience où il a recueilli du fluor et de l'air puis a rempli de flacon de platine. Henri Moissan a obtenu une densité de 1,264 à 0 °C et 760 mmHg. Il a ensuite calculé la densité théorique en multipliant la densité de l'hydrogène et le poids atomique du fluor, il a trouvé 1,316.
Isotopes
Le fluor possède en tout dix-huit isotopes mais seul le fluor 19 (19F) est stable. Les autres isotopes les plus stables sont le fluor 18 (18F) d'une demi-vie de 1,8293h soit environ 110min et le fluor 20 (20F) d'une demi-vie de 11,163s. Sur Terre, il n'y aucun Fluor 18 naturel car le Fluor 19 est abondant à 100 % et donc le seul isotope naturel. Tous ses isotopes non stables se transforment en oxygène ou en néon.
L'isotope le plus abondant, Fluor 19, est produit sur Terre par désintégration bêta de l'oxygène 19 (19O) ou par capture électronique du néon 19 (19Ne). Dans le cas de la capture électronique, un proton du néon capture un électron ce qui le transforme en neutron. Dans le cas de la désintégration β-, un neutron de l'atome d'oxygène est converti en proton :
Le fluor 19 possède 19 nucléons dont 10 neutrons et 9 protons, c'est un boson avec un spin 1/2+ pour une masse atomique de 18,9984032 g/mol. Il est caractérisé par un excès de masse de -1 487,405±0,070 keV/c² et une énergie de liaison nucléaire de 147 801 358±74 eV.
On peut fabriquer d'autres isotopes par réactions nucléaires, instables, qui se désintègrent rapidement, peu dépassent la minute. L'isotope ayant la demi-vie la plus courte est le fluor 16, qui se désintègre par émission d'un proton en 40 keV. Le fluor 17 se désintègre par capture électronique en 64,49 s. Le fluor 20, fluor 21, fluor 22, fluor 23, fluor 24 et fluor 25 se désintègrent par désintégration β- en 11 s, 4,158 s, 4,23 s, 2,23 s, 0,34 s et 0,059 s, respectivement.
Le fluor 18 est le radioisotope le plus stable qui puisse être fabriqué. Sa demi-vie est approximativement de 110 min. Ce fermion compte 9 protons et 9 neutrons avec un spin 1+ pour une masse atomique de 18,0009377 g/mol. Il est caractérisé par un excès de masse de 873 431±593 eV/c2 et une énergie de liaison nucléaire de 137 369 199±593 eV.
Spectre
Au XIXe siècle, peu de temps avant l'isolation de l'élément, le savant Georges Salet a déterminé quelques raies du fluor en comparant les spectres d'émission du chlorure et du fluorure de silicium. Les Fα présentent des raies à 692, 686 et 678 nm environ chacune. Les Fβ présentent une raie à 640 nm et les Fγ à 623 nm. Henri Moissan a repris les expériences de Salet et a utilisé des électrodes de platine puis des électrodes d'or. Il a pu comparer le spectre de Salet avec ceux fournis par certains fluorures. Avec les électrodes de platine, on obtient plusieurs raies de longueur d'onde 744, 740, 734, 714, 704, 691, 687,5, 685,5, 683,5, 677, 640,5, 634 et 623 nm alors que les électrodes d'or ne permettent pas d'avoir les longueurs d'onde 744 et 740 nm.
Combustion
Le fluor est un gaz ininflammable mais qui peut produire une flamme en réagissant avec beaucoup de substances chimiques. Il peut réagir violemment avec un grand nombre de composés chimiques et avec l'eau, même à basse température, et forme de l'ozone et de l'acide fluorhydrique.
- 3F2 + 3H2O → O3 + 6HF
Gaz
Plasma
Liquide
Superfluide
Solide
Composés
Le difluor pur est un gaz jaune pâle corrosif : c’est un oxydant puissant. Elément le plus réactif et le plus électronégatif, il forme des composés avec la plupart des autres éléments, y compris les gaz rares xénon et radon.
Même dans des conditions de basse température et sans lumière, le difluor réagit explosivement avec le dihydrogène, même en dessous de -250 °C lorsque le fluor est solide et l’hydrogène liquide ! Dans un jet de gaz difluor, le verre, les métaux, l’eau et d’autres substances brûlent avec une flamme lumineuse. Le fluor a une telle affinité pour la plupart des éléments, en particulier pour le silicium (Si), qu’il ne peut ni être préparé ni être conservé dans des récipients de verre (constitués principalement de silice SiO2).
Minéraux
Parmi ceux-ci, la fluorine est un fluorure de calcium de composition CaF2.