Gaz parfait - Définition
La liste des auteurs de cet article est disponible ici.
Mélange de gaz parfaits
Pour ce qui est d’un mélange idéal de gaz parfaits, on dispose de la loi de Dalton :
-
p = ∑ pi i
où pi désigne la pression partielle du gaz i, c'est-à-dire la pression qu’aurait le gaz i s’il occupait seul tout le volume.
Soit un gaz parfait de molécules A occupant un volume V1, et un gaz parfait de molécules B de volume V2, séparés par une cloison ils sont en équilibre (même température T et même pression P0). Il n'est pas du tout évident que pour une même pression et une même température, le mélange obtenu en enlevant la cloison soit un système de même pression, de même température et de volume V1+V2. À titre de comparaison, si l'on mélange 1 L d'eau et 1 L d'alcool, on obtient 1,84 L d'eau alcoolisée ; certes ce ne sont pas des gaz parfaits, mais cela montre que les propriétés ne sont pas toujours additives.
Considérons que les gaz soient chimiquement neutres, c'est-à-dire que les molécules de A et de B n'interagissent pas : d'après le paragraphe précédent,
- A subit alors une détente de Joule de V1 à V1+V2, puisqu'il ne « voit » pas B (pas d'interaction) ;
- symétriquement, B subit une détente de Joule de V2 à V1+V2.
Ainsi la température n'a pas changé et la pression sur les parois est due à A et B, soit
-
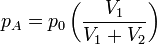
-
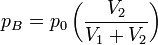
La pression totale est pA + pB = p0 : la pression n'a pas changé, la loi de Mariotte reste donc vraie. En revanche, il y a eu « perte d'information par mixage », il s'agit du paradoxe de Gibbs.
S'il n'y a pas interaction entre A et B, l'énergie interne est simplement celle de A plus celle de B : la loi de Joule reste vraie. Donc le mélange se comporte comme un gaz parfait.
Le mélange de deux gaz parfaits de Laplace est un gaz parfait de Laplace, mais dont le facteur γ n'est pas la moyenne pondérée des γ : ce sont CV et Cp qui sont les moyennes pondérées.
L'entropie d'un mélange est la somme des entropies de chacun des gaz pris sous sa pression partielle (cf. paradoxe de Gibbs). Ce point est capital : il sera la clef en chimie de la loi d'action de masses.
Gaz parfait et théorie cinétique des gaz
Les gaz parfaits font l'objet d'une théorie dite théorie cinétique des gaz expliquant les lois physiques qui les régissent.
Au-delà du gaz parfait
Gaz réel
À basse pression, tous les gaz peuvent être modélisés par un gaz parfait. Lorsque la pression augmente, on ne peut plus négliger les interactions à courte distance, notamment l'effet de taille des molécules et les interactions de type van der Waals.
Un gaz réel a un comportement voisin d'un gaz parfait dans le cas où les distances intermoléculaires sont grandes par rapport à la taille des molécules et à la portée des forces d'interaction. On appelle gaz parfait « associé au gaz réel » le gaz parfait dont la capacité calorifique à pression constante est celle du gaz réel à pression nulle Cp(p = 0,T). On dresse les tables thermodynamiques d'un gaz réel à partir des corrections apportées à ce gaz parfait associé.
Gaz parfait quantique
Dans la limite des fortes densités, la nature quantique des atomes ou molécules de gaz doit être prise en compte. On peut donner comme critère que le modèle classique n'est valable que si la distance interatomique est très supérieure à la longueur d'onde de de Broglie
![d = \sqrt[3]{V/N} >> \lambda = h / p](https://upload.wikimedia.org/math/d/7/c/d7c6fa252f199a8f919341e77f55fcea.png) .
.
Gaz parfait relativiste
Le gaz parfait relativiste est une généralisation du gaz parfait aux cas où les particules de gaz ont des vitesses proches de celles de la lumière. Il faut alors prendre en compte les effets de la relativité dans le calcul des différentes propriétés du gaz. Ainsi, si la loi des gaz parfait reste valable, l'énergie et la chaleur spécifique sont modifiées par les effets relativistes.