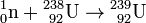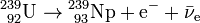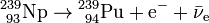Plutonium - Définition
La liste des auteurs de cet article est disponible ici.
Origine
Le plutonium est un élément chimique artificiel presque exclusivement produit de 1940 à nos jours. C'est le deuxième des transuraniens à avoir été découvert. L'isotope 238Pu a été produit en 1940 en bombardant une cible d'uranium par du deutérium au cyclotron de Berkeley. Durant le Projet Manhattan, le plutonium 239 avait le nom de code 49, le '4' étant le dernier chiffre de 94 (le numéro atomique) et le '9', le dernier chiffre de 239 (l'isotope utilisé pour la bombe, le 239Pu).
Le plutonium est normalement absent de la biosphère, mais il a existé (et existe encore en quantités infimes) sous forme de 239Pu dans des structures géologiques particulières où de l'uranium a été naturellement concentré par des processus géologiques ou géobiologiques (bioconcentration en filons par des bactéries) il y a environ 2 milliards d'années, pour atteindre une criticité suffisante pour engendrer une réaction nucléaire naturelle. C'est le cas sur le site d'Oklo. On en trouve également des traces dans les minerais d'uranium naturel (de même que du neptunium), où il résulte de l'irradiation de l'uranium par les neutrons présents.
On le trouve également dans des terres rares sous forme de très faibles trace de 244Pu, ce qui en fait l'élément naturel le plus lourd identifié à ce jour.
Production
Plutonium 239 et isotopes supérieurs
L'irradiation de l'uranium 238 dans les réacteurs nucléaires génère du plutonium 239 par capture de neutrons. Dans un premier temps, un atome d'uranium 238 capture un neutron et se transforme transitoirement en uranium 239. Cette réaction de capture est plus facile avec des neutrons rapides qu'avec des neutrons thermiques, mais est présente dans les deux cas.
L'uranium 239 formé est fortement instable. Il se transforme rapidement (avec une demi-vie de 23,5 minutes) en neptunium par radioactivité β- :
Le neptunium 239 est également instable, et subit à son tour une décroissance β- (avec une demi-vie de 2,36 jours) qui le transforme en plutonium 239 relativement stable (demi-vie de 24 000 ans).
Le plutonium 239 est fissile, et contribue à la réaction en chaîne du réacteur ; mais il peut également capturer un neutron sans subir de fission. Quand le combustible subit des périodes d'irradiation de plus en plus longues, les isotopes supérieurs s'accumulent en raison de l'absorption de neutrons par le plutonium 239 et ses produits. Il se forme ainsi des isotopes 240Pu, 241Pu, 242Pu, jusqu'au 243Pu instable qui se désintègre en américium 243.
- L'isotope intéressant par son caractère fissile est le 239Pu, relativement stable à échelle humaine (24 000 ans).
- L'isotope suivant, le 240Pu, est simplement fertile, et présente une radioactivité "seulement" quatre fois plus élevée (6 500 ans).
- Le 241Pu est également fissile, mais fortement radioactif (demi-vie de 14 ans).
En outre il se désintègre en produisant de l'américium 241 neutrophage, ce qui réduit l'efficacité des dispositifs nucléaires militaires.
Le rythme de production d'un isotope dépend de la disponibilité de son précurseur, qui doit avoir eu le temps de s'accumuler.
Dans un combustible neuf, le Pu 239 se forme donc linéairement en fonction du temps, la proportion de Pu 240 augmente suivant une loi au carré du temps (en t2), celle de Pu 241 suivant une loi au cube du temps (en t3), et ainsi de suite.
Ainsi, quand on utilise un réacteur spécifique pour la fabrication du « plutonium militaire », le combustible utilisé pour la production du plutonium aussi bien que les cibles et la couverture s'il y en a, sont extraits après un bref séjour (quelques semaines) dans le réacteur afin d'avoir l'assurance que le plutonium 239 est aussi pur que possible.
En revanche, pour des usages civils, une brève irradiation n'extrait pas toute l'énergie que le combustible peut produire. On n'enlève donc le combustible des réacteurs électrogènes qu'après un séjour beaucoup plus long (3 ou 4 ans).
En première approximation, un réacteur produit typiquement 0,8 atome de 239Pu pour chaque fission de 235U, soit un gramme de plutonium par jour et par MW de puissance thermique (les réacteurs à eau légère produisant moins que les graphite-gaz). Ainsi, en France, les réacteurs nucléaires produisent chaque année environ 11 tonnes de plutonium.
Plutonium 244
Le plutonium 244, l'isotope le plus stable d'une demi-vie de 80 millions d'années, ne se forme pas dans les réacteurs nucléaires. En effet, les captures neutroniques successives conduisent au 243Pu, de très faible demi-vie (de l'ordre de cinq heures). Même dans des réacteurs "à haut flux", le 243Pu se transforme rapidement en 244Am, sans avoir le temps de capturer un neutron supplémentaire pour former le 244Pu. En revanche, des flux neutroniques plus importants (d'une explosion nucléaire, ou de l'explosion d'une supernova) permettent cette formation.
Les traces de 244Pu dans l'environnement sont généralement attribuées aux essais nucléaires atmosphériques ainsi qu'à des reliquats de 244Pu primordial. Il est aussi synthétisé lors des explosions nucléaires : en 1952, l'explosion de la bombe thermonucléaire américaine la plus puissante a ainsi produit deux radioéléments alors encore inconnus : le plutonium 244 (244Pu) et le plutonium 246 (246Pu).
Plutonium 238
Dans les centrales nucléaires, du plutonium 238 est formé parallèlement au plutonium 239, par la chaîne de transformation commençant par l'uranium 235 fissible.
- L'uranium 235 qui capture un neutron thermique peut se stabiliser par émission d'un rayonnement γ dans 16 % des cas. Il forme alors un atome d'U 236, relativement stable (demi-vie de 23 million d'années).
- Une deuxième capture neutronique le transforme en U 237 (pour mémoire, des atomes d'U 238 peuvent également subir une réaction (n, 2n) qui les transforment en U 237 par perte d'un neutron). L'uranium 237 est instable avec une demi-vie de 6,75 jours, et se transforme par émission β- en neptunium 237, relativement stable (demi-vie de 2,2 millions d'années).
- Une troisième capture neutronique transforme le noyau en neptunium 238, instable de demi-vie 2,1 jours, qui se transforme en plutonium 238 par émission β-.
Le plutonium 238, d'une demi-vie de 86,41 ans, est un émetteur très puissant de rayonnement α. En raison de son activité massique alpha et gamma élevée, il est utilisé comme source de neutrons (par "réaction alpha" avec des éléments légers), comme source de chaleur et comme source d'énergie électrique (par la conversion de la chaleur en électricité). Les utilisations du Pu 238 pour produire de l'électricité sont cantonnées aux utilisations spatiales, et par le passé à certains stimulateurs cardiaques.
On prépare le plutonium 238 à partir de l'irradiation neutronique du neptunium 237, un actinide mineur récupéré pendant le retraitement ou à partir de l'irradiation de l'américium, en réacteur. Dans les deux cas, pour extraire le plutonium 238 des cibles, on les soumet à un traitement chimique, comportant une dissolution nitrique.
Il n'y a qu'environ 700 g/t de neptunium 237 dans le combustible des réacteurs à eau ordinaire irradié pendant 3 ans, et il faut l'extraire sélectivement.