Physique de la radioactivité - Définition
La liste des auteurs de cet article est disponible ici.
Loi de désintégration radioactive
La décroissance radioactive est la réduction du nombre de noyaux radioactifs (instables) dans un échantillon. La décroissance radioactive se produit jusqu'à ce que tous les noyaux de l'échantillon soient stables. Un radionucléide quelconque a autant de chances de se désintégrer à un moment donné qu'un autre radionucléide de la même espèce, et la désintégration ne dépend pas des conditions physico-chimiques dans lesquelles le nucléide se trouve. En d'autres termes, la désintégration est régie par le hasard, et la loi de désintégration radioactive est une loi statistique. Soit N(t) le nombre de radionucléides d'une espèce donnée présents dans un échantillon à un instant t quelconque. Comme la probabilité de désintégration d'un quelconque de ces radionucléides ne dépend pas de la présence des autres radionucléides ni du milieu environnant, le nombre total de désintégrations dN pendant un bref intervalle de temps dt à l'instant t est proportionnel au nombre de radionucléides de même espèce N présents et à la durée dt de cet intervalle. On montre facilement que le nombre d'atomes décroît exponentiellement :
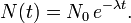
La période des radioéléments naturels varie dans des proportions énormes allant, pour ceux repris dans le tableau ci-dessous, de 0,3 µs pour le polonium 212 jusqu'à 1,405×1010 ans pour le thorium 232.
| Radioisotope | Notation | Numéro atomique Z | Abondance relative | Période radioactive | Rayonnement émis f–1 | Produit ( * = radioactif) |
| Rubidium 87 | 87Rb | 37 | 27,835 % | 47 x 109 a | β– | 87Sr |
| Rhénium 187 | 187Re | 75 | 62,6 % | 43,5 x 109 a | α, β– | 183Ta, 187Os |
| Lutécium 176 | 176Lu | 71 | 2,59 % | 37,8 x 109 a | β– | 176Hf |
| Thorium 232 | 232Th | 90 | 100 % | 14,05 x 109 a | α | 228Ra * |
| Uranium 238 | 238U | 92 | 99,28 % | 4,5 x 109 a | α | 234Th * |
| Potassium 40 | 40K | 19 | 0,01167 % | 1,277 x 109 a | β+, β– | 40Ar, 40Ca |
| Uranium 235 | 235U | 92 | 0,718 % | 703,8 x 106 a | α | 231Th * |
| Uranium 234 | 234U | 92 | 0,0056 % | 245,5 x 10³ a | α | 230Th * |
| Carbone 14 | 14C | 6 | traces | 5730 a | β– | 14N |
| Radium 226 | 226Ra | 88 | traces, 100 % | 1602 a | α | 222Rn * |
| Actinium 227 | 227Ac | 89 | traces, 100 % | 21,773 a | β–, α | 227Th *, 223Fr * |
| Polonium 210 | 210Po | 84 | traces | 138,376 d | α | 206Pb |
| Thorium 234 | 234Th | 90 | traces | 24,1 d | β | 233Pa * |
| Radon 222 | 222Rn | 86 | traces, 100 % | 3,824 d | α | 218Po * |
| Radon 220 | 220Rn | 86 | traces | 54,5 s | α | 216Po * |
| Polonium 216 | 216Po | 84 | traces | 0,158 s | α | 212Pb * |
| Polonium 215 | 215Po | 84 | traces | 1,83 ms | α | 211Tl * |
| Polonium 212 | 212Po | 84 | traces | 0,29 µs | α | 208Pb |
Rayonnements émis dans les processus radioactifs
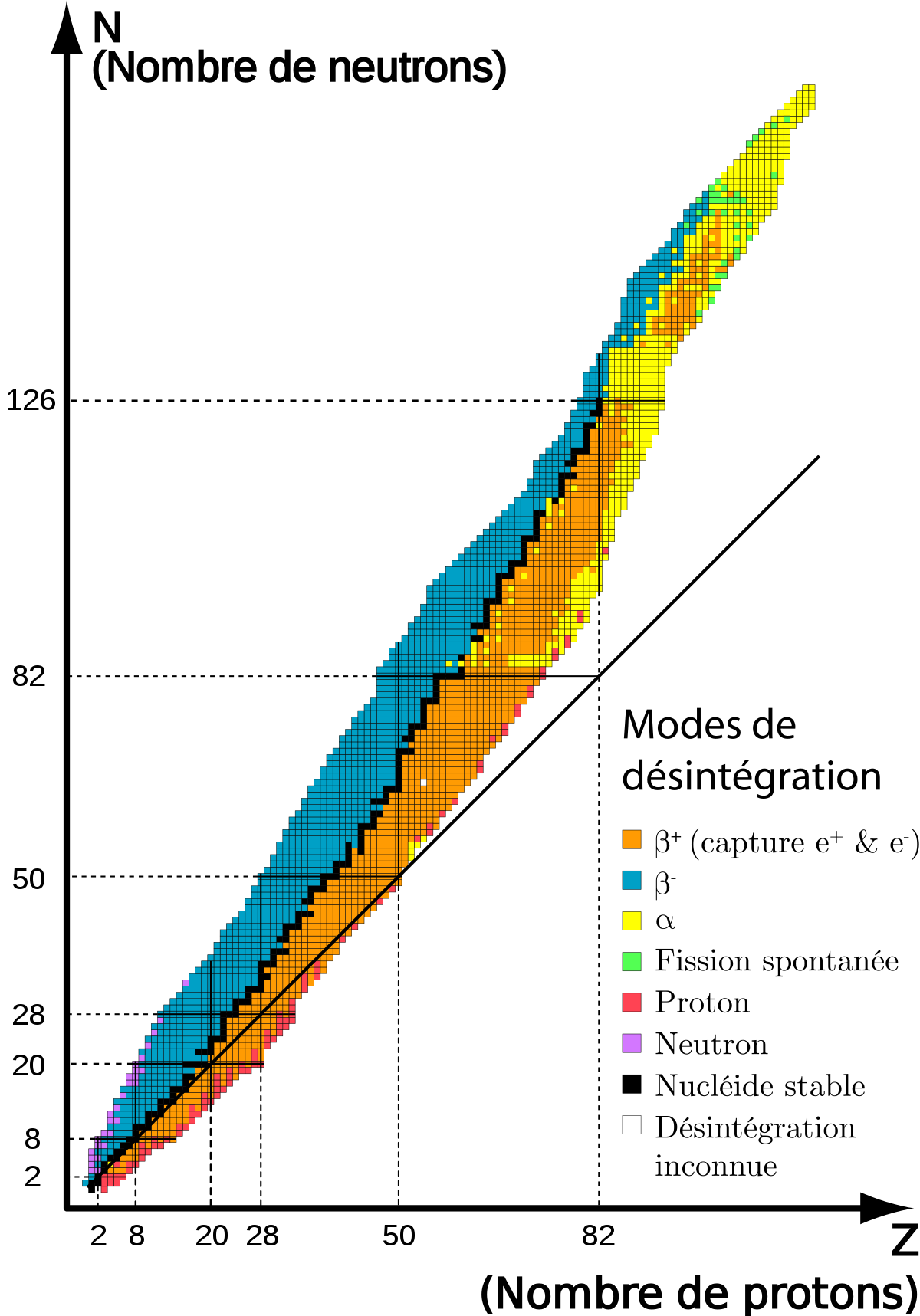
Les rayonnements émis par les noyaux atomiques radioactifs sont appelés, selon le cas, des rayons α, des rayons β ou des rayons γ. Dans un jargon franglais couramment utilisé, on distingue ainsi une radioactivité α, une radioactivité β (subdivisée en radioactivité β– et en radioactivité β+), et une radioactivité γ :
- La radioactivité alpha (α) désigne la radioactivité lors de laquelle un noyau d'atome X(Z,A) de numéro atomique Z et de nombre de masse A se transforme spontanément en un autre noyau atomique Y(Z − 2,A − 4) de numéro atomique Z − 2 et de nombre de masse A − 4 et en un noyau d'hélium ou hélion He(2,4) de numéro atomique 2 et de nombre de masse 4, celui-ci étant émis en emportant une fraction de l'énergie de masse libérée par la transformation :
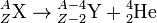
Ces hélions, encore appelés particules alpha, ont une charge 2e, où e désigne la charge électrique élémentaire, et une masse de 4,001 505 8 unités de masse atomique.
- La radioactivité bêta moins (β–) affecte les nucléides X(Z,A) présentant un excès de neutrons. Elle se manifeste par la transformation spontanée dans le noyau d'un neutron n(0,1) en proton p(1,1), le phénomène s'accompagnant de l'émission d'un électron (ou particule bêta moins) e-(–1,0) et d'un antineutrino ν(0,0) :
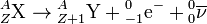
.
- La radioactivité bêta plus (β+) ne concerne que des nucléides « artificiels », obtenus dans des réactions nucléaires provoquées, qui présentent un excès de protons. Elle se manifeste par la transformation dans le noyau d'un proton p(1,1) en neutron n(0,1), le phénomène s'accompagnant de l'émission d'un positon (ou positron, ou encore particule bêta plus) e+(+1,0) et d'un neutrino ν(0,0) :
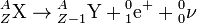
.
- La radioactivité gamma (γ) : les désintégrations α, β– et β+ sont toujours accompagnées de l'émission de photons de haute énergie ou rayons gamma, dont les longueurs d'onde sont généralement encore plus courtes que celles des rayons X, étant de l'ordre de 10–9 m ou inférieures. Cette émission gamma (γ) résulte de transitions à partir de niveaux d'énergie excités du noyau. Le spectre émis est un spectre de raies qualitativement comparable aux spectres infrarouge, optique et ultraviolet qui résultent des transitions entre les différents niveaux d'énergie dans les atomes, mais quantitativement la différence provient du fait que les énergies mises en jeu dans les atomes sont de l'ordre de l'électron-volt (eV), alors que dans les noyaux atomiques elles sont environ un million de fois plus élevées et sont de l'ordre du MeV. Il convient de ne pas confondre la radioactivité (la cause) avec les rayonnements (l'effet) qu'elle produit ; en effet, les mêmes rayonnements sont aussi produits par des processus physiques et astrophysiques qui n'ont rien à voir, de près ou de loin, avec la radioactivité.
Il est à remarquer que la radioactivité peut provenir de radioéléments naturels ou de radioéléments artificiels, ces derniers étant produits au laboratoire et dans des réacteurs nucléaires fabriqués par les êtres humains ou se constituant tout à fait exceptionnellement de façon spontanée dans la Nature, comme celui qui semble avoir fonctionné il y a deux milliards d'années sur le site d'Oklo au Gabon, ou encore lors d'explosions de bombes atomiques. Dans le premier cas, on parle alors souvent de radioactivité naturelle, pour insister sur le fait que la radioactivité est produite par des radioéléments se rencontrant avec des abondances plus ou moins grandes (mais toujours assez faibles) dans la Nature, bien qu'en elle-même la radioactivité, quel que soit le noyau atomique instable considéré, soit toujours naturelle et que l'expression soit donc un pléonasme. Dans le deuxième cas, on parle de radioactivité artificielle, terme qui en soi est un non-sens, mais qui est néanmoins le terme consacré depuis que les époux Frédéric Joliot (1900–1958) et Irène Curie (1897–1956) ont reçu en 1935 le prix Nobel de chimie « pour la découverte de la radioactivité artificielle »
Les radioéléments les plus fréquents dans les roches terrestres sont l'isotope 238 de l'uranium : 238U ou U(92,238), l'isotope 232 du thorium : 232Th ou Th(90,232), et surtout l'isotope 40 du potassium : 40K ou K(19,40). Outre ces isotopes radioactifs naturels encore relativement abondants, il existe dans la Nature des isotopes radioactifs en abondances beaucoup plus faibles. Il s'agit notamment des éléments instables produits lors de la suite de désintégrations des isotopes mentionnés, par exemple de divers isotopes du radium et du radon. Un autre radioélément naturel est l'isotope 235 de l'uranium : 235U ou U(92,235), qui se trouve dans la Nature en concentrations très faibles associées à l'isotope 238U, mais dont on « enrichit » la concentration par des techniques adaptées pour qu'il puisse servir à des besoins civils et militaires. Un autre radioisotope naturel est le radiocarbone, c'est-à-dire l'isotope 14 du carbone : 14C ou C(6,14). Ce dernier est constamment produit dans la haute atmosphère par des rayons cosmiques interagissant avec l'azote, et se détruit par désintégrations radioactives à peu près au même taux qu'il est produit, de sorte qu'il se produit un équilibre dynamique qui fait que la concentration du 14C reste plus ou moins constante au cours du temps dans l'air et dans les organismes vivants qui respirent cet air. Une fois un organisme mort, la concentration en 14C diminue dans ses tissus, et permet de dater le moment de la mort. Cette datation au radiocarbone est un outil de recherche très prisé en archéologie et permet de dater avec une bonne précision des objets organiques dont l'âge ne dépasse pas cinquante à cent mille ans.

















































