Dihydroxyacétone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| dihydroxyacétone | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
| Synonymes | dihydroxyacétone; DHA |
| No CAS | |
| No EINECS | |
| PubChem | |
| FEMA | |
| SMILES | |
| InChI | |
| Apparence | Poudre blanche cristalline |
| Propriétés chimiques | |
| Formule brute | C3H6O3 |
| Masse molaire | 90,0779 ± 0,0037 g·mol-1 |
| Propriétés physiques | |
| T° fusion | 75 à 80 °C |
| T° ébullition | 586 °C |
| Solubilité | Eau 1:1 Ethanol 1:15 |
| Écotoxicologie | |
| DL | 16 g·kg-1 (voie orale) |
| | |
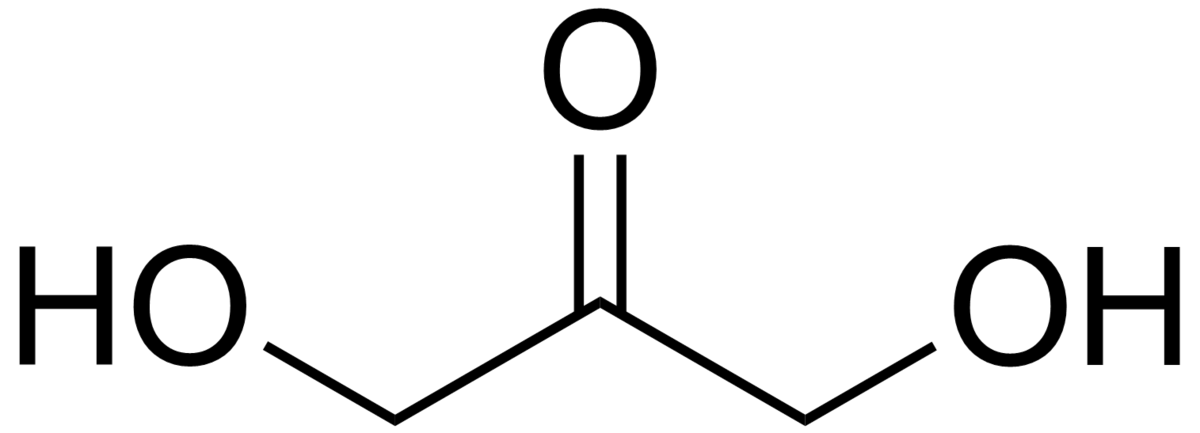
Le dihydroxyacétone, ou DHA, est un ose de formule brute est C3H6O3.
Description
Le dihydroxyacétone est composé de trois atomes de carbone, ce qui en fait un triose. C'est un cétose car son groupement carbonyle est situé en milieu de chaîne carbonée. A l'inverse de son isomère aldose, le glycéraldéhyde, ce n'est pas une molécule chirale, puisqu'elle ne possède aucun carbone asymétrique.
Une des caractéristiques du dihydroxyacétone est que ses groupes fonctionnels possèdent des éléments de symétrie. La molécule elle-même présente une symétrie axiale, c'est-à-dire qu'elle est superposable à son image dans un miroir (l'oxygène porté par le second carbone est placé à droite à titre indicatif), caractéristique qui en fait une exception parmi les oses connus.
Schéma de la molécule :
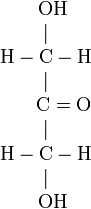
Elle est produite naturellement par bioconversion bactérienne de glycérol.
Dihydroxyacétone phosphate
La dihydroxyacétone phosphate ou phosphodihydroxyacétone (PDHA), est un des intermédiaires de la glycolyse.
Schéma de la molécule, le groupement phosphate étant en rouge :
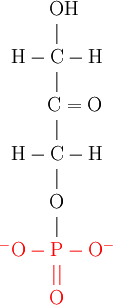
La PDHA est produite par clivage aldolique du fructose-1,6-bisphosphate avec comme coproduit le glycéraldéhyde-3-phosphate. C'est une réaction réversible dont l'enzyme est l'aldolase.
Comme seul le glycéraldéhyde-3-phosphate est substrat pour la suite de la glycolyse, la PDHA est entièrement transformé en glycéraldéhyde-3-phosphate par isomérisation.
Schéma de la réaction :
Cette réaction est catalysée par la triose phosphate isomérase. Cet enzyme est considéré comme ayant atteint la perfection cinétique, c'est-à-dire que le quotient de sa constante catalytique par sa constante de Michaelis tend vers 1. Cela se traduit par le fait que seule la concentration en réactant disponible limite son activité.
Utilisations esthétiques
Obtenue généralement par bioconversion du maïs ou de la canne à sucre, la DHA est fréquemment utilisée en cosmétique, notamment elle constitue la molécule pour l'élaboration des autobronzants actuels. La DHA agit par réaction de Maillard sur les kératines de la couche cornée de la peau, créant ainsi un hâle d'aspect plus naturel que les classiques autobronzants donnant une couleur dans les tons orange. Le renouvellement fréquent de la couche cornée (composée principalement de cellules mortes) explique la disparition progressive de la coloration.
Cette méthode de bronzage artificiel ne fait nullement intervenir les mélanocytes et il n'y a pas production de mélanine. Le brunissement par application de DHA n'a donc pour ainsi dire pas d'effet protecteur vis-à-vis des radiations ultraviolettes comme celui assuré par la mélanine. Il y a absorption dans certains cas des UVA, faiblement énergétiques, mais non des UVB, véhiculant une énergie plus importante, qui représente un plus grand danger de l'exposition au soleil.
Du fait de sa non-pénétration au-delà de la couche cornée, aucun effet secondaire gênant n'est actuellement connu à l'application de DHA sur la peau. Une coloration accrue des comédons ( « points noirs » ) peut être observée.
La DHA est naturellement présente dans l'organisme et par conséquent particulièrement biocompatible, ce qui évite tout risque d’allergie.

















































