Acide sulfurique - Définition
La liste des auteurs de cet article est disponible ici.
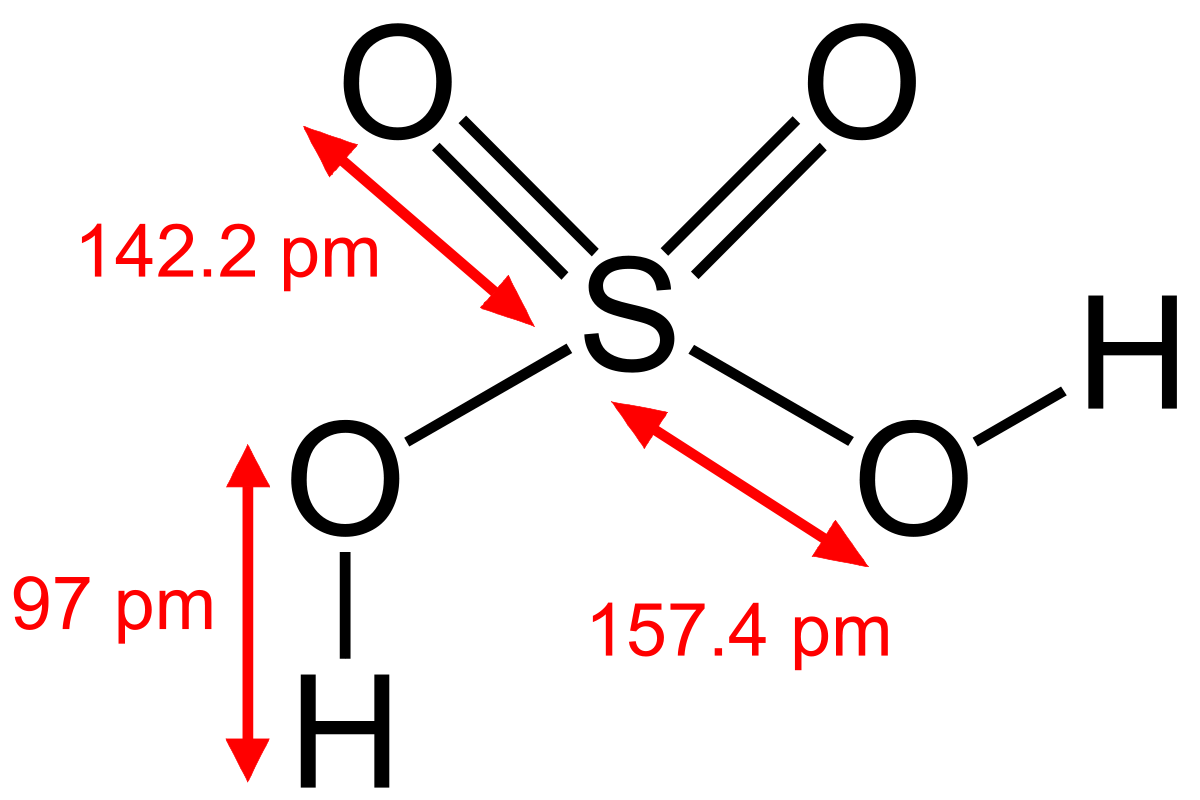
Propriétés
Propriétés physiques
L'acide sulfurique pur est un liquide visqueux, incolore et inodore. Diverses impuretés le colorent souvent en jaune brun. Sa concentration est souvent exprimée en degré Baumé.
Il existe un mélange azéotrope avec l'eau (98,3% d'H2SO4 et 1,7% d'eau) T° d'ébullition : 338 °C
L'acide sulfurique est un diacide. La première acidité est forte (pKa ~ -7), la seconde plus faible (pKa = 1,99).
Les sels sont les hydrogénosulfates HSO4- et les sulfates SO42-.
Propriétés chimiques
Propriétés propres
Si, lors de la préparation de l'acide, de grandes concentrations de trioxyde de soufre SO3 (g) sont utilisées, il se forme une solution de SO3 (solv) dans H2SO4 (l) qui est appelée « acide sulfurique fumant » ou oléum.
Sous l'action de la chaleur, l'acide sulfurique se décompose en trioxyde de soufre et en eau. La réaction est pratiquement complète à 450 °C (ΔH de décomposition = +177 kJ/mol).
À température plus élevée, le trioxyde de soufre se décompose en dioxyde de soufre et en oxygène.
L'acide sulfurique concentré est un produit oxydant et déshydratant.
Combinaison avec d'autres acides
En combinaison avec l'acide nitrique, l'acide sulfurique forme l'ion nitronium, qui est employé dans la nitration des composés. Le processus de la nitration est employé pour fabriquer de nombreux explosifs, y compris le trinitrotoluène, la nitroglycérine, et le coton-poudre.
Combinaison avec de l'eau
La réaction d'hydratation de l'acide sulfurique dégage beaucoup de chaleur : elle peut même conduire à faire bouillir l'eau dans laquelle l'acide sulfurique est versé, voire provoquer des explosions avec projection de liquide (un peu comme lorsqu'on jette de l'eau dans de l'huile bouillante).
Comme l'hydratation de l'acide sulfurique est thermodynamiquement favorable, l'acide sulfurique est un excellent agent de déshydratation, et s'emploie pour préparer de nombreux fruits secs.
L'affinité de l'acide sulfurique pour l'eau est telle qu'il est capable de déshydrater un grand nombre de composés. Par exemple, un mélange de glucose (C6H12O6) et d'acide sulfurique concentré produit du carbone ainsi que de l'eau.
Autres combinaisons
Comme tous les acides forts, l'acide sulfurique réagit vivement avec de nombreux produits organiques, les métaux en poudre, les carbures, les chlorates, les chromates, les nitrates, les permanganates, les fulminates, le fluosilicium et le bronze en poudre de façon très exothermique. La réaction peut être explosive.
L'acide sulfurique concentré réagit violemment avec les bases fortes anhydres ou en solutions concentrées.
Les principaux métaux usuels sont attaqués avec dégagement de dihydrogène. L'acide dilué attaque le zinc, le fer, le cuivre et certaines fontes, mais pas le plomb. L'acide sulfurique concentré n'a pas d'action sur le fer, l'acier et la fonte à froid, mais, à chaud, presque tous les métaux usuels réagissent, y compris certaines fontes.
Fabrication
La préparation industrielle de l'acide sulfurique se fait selon deux procédés : celui dit « de contact », qui est le plus utilisé, et le procédé dit « des chambres de plomb ».
Le procédé de contact consiste à oxyder de l'anhydride sulfureux en anhydride sulfurique en présence d'un catalyseur (jadis platine, aujourd'hui composé de vanadium). L'anhydride sulfurique ainsi formé est ensuite absorbé dans une solution d'acide sulfurique qui ruisselle dans des tours dites « tours d'absorption ». Lorsque cette solution est suffisamment concentrée, elle est recueillie et stockée.
Le procédé des chambres de plomb, dans sa version la plus moderne (procédé Petersen), s'effectue par une réaction entre du dioxyde de soufre, de l'eau et de l'oxygène, qui se combinent pour donner l'acide sulfurique. Cette réaction est catalysée par des oxydes d'azote continuellement recyclés.
Le procédé des chambres de plomb, dû à John Roebuck en 1746, fournit un acide sulfurique moins concentré et contenant plus d'impuretés, plutôt destiné à la fabrication des superphosphates.
À partir de l'acide sulfurique, on peut préparer des sels neutres contenant le groupe sulfate SO42-, et des sels acides contenant le groupe hydrogénosulfate HSO4-.