Combustion - Définition
La combustion est une réaction chimique exothermique (c’est-à-dire accompagnée d’une production d'énergie sous forme de chaleur ).
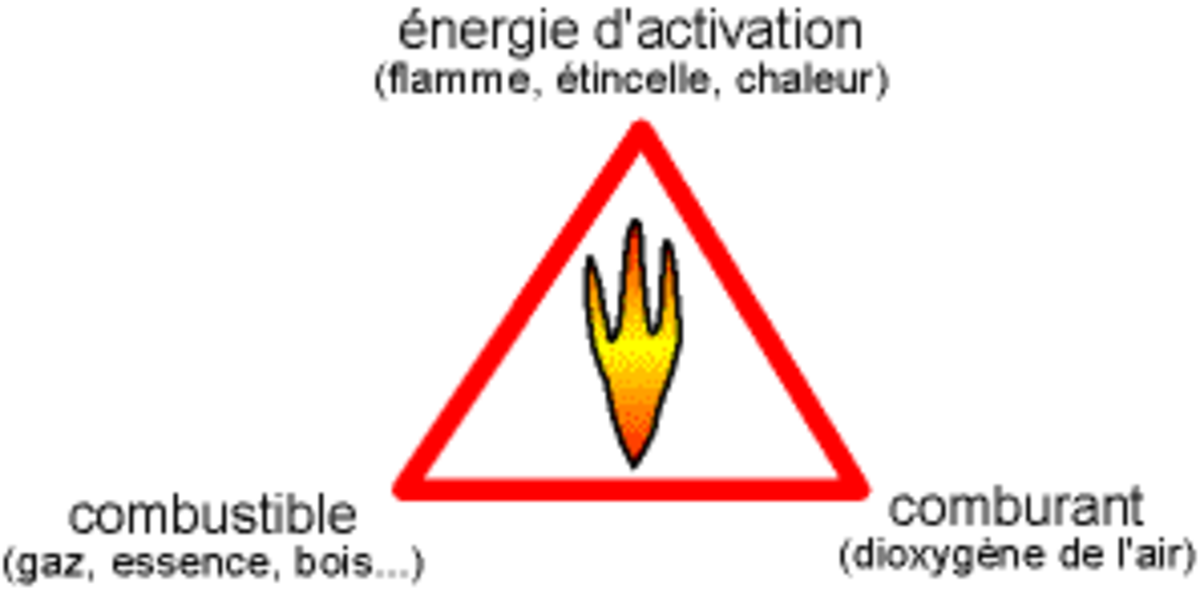
Triangle du feu
La réaction chimique de combustion ne peut se produire que si l'on réunit trois éléments : un combustible, un comburant, une énergie d'activation en proportion suffisante. On représente de façon symbolique cette association par le triangle du feu.
Le combustible peut être:
- un gaz (butane, propane, gaz de ville, dihydrogène…),
- un liquide (essence, gasoil, huile, kérosène…),
- un solide (bois, papier, carton, tissu, plastique…).
Ce peut être un mélange de différents corps.
Le comburant est l’autre réactif de la réaction chimique. La plupart du temps, il s’agit de l’air ambiant, et plus particulièrement de l’un de ses composants principaux, le dioxygène. En privant un feu d’air, on l’éteint ; par exemple, si on place une bougie chauffe-plat allumée dans un bocal de confiture et qu’on ferme le bocal, la flamme s’éteint ; à l’inverse, si l’on souffle sur un feu de bois, cela l’active (on apporte plus d’air). Dans certains chalumeaux, on apporte du dioxygène pur pour améliorer la combustion.
Dans certains cas très particuliers (souvent explosifs), le comburant et le combustible sont un seul et même corps (par exemple la célèbre nitroglycérine, molécule instable comportant une partie oxydante greffée sur une partie réductrice).
La réaction est déclenchée par une énergie d’activation. La production de chaleur permet à cette réaction de s’auto-entretenir dans la plupart des cas, voire de s'amplifier en une réaction en chaîne.
L’énergie d’activation est le déclencheur du feu. Il s’agit généralement de chaleur. Par exemple, ce sera l’allumette que l’on frotte, le câble électrique qui chauffe, ou une autre flamme (propagation du feu), étincelle (de l’allume-gaz, de la pierre du briquet ou d’un appareil électrique qui se met en route ou s’arrête). Mais il y a d’autres façons de fournir l’énergie d’activation : électricité, radiation, pression… qui permettront toujours une augmentation de la température.
Procédés d'extinction d'une combustion
Pour éteindre une réaction de combustion, il faut supprimer un de trois éléments du triangle du feu :
- suppression du combustible : fermeture d'une vanne ou d'un robinet qui alimente la combustion…
- suppression du comburant (étouffement) : utilisation d'un extincteur à neige carbonique, d'une couverture…
- suppression de l'énergie d'activation (refroidissement) : utilisation d'un extincteur à eau pulvérisée…
Approche chimique
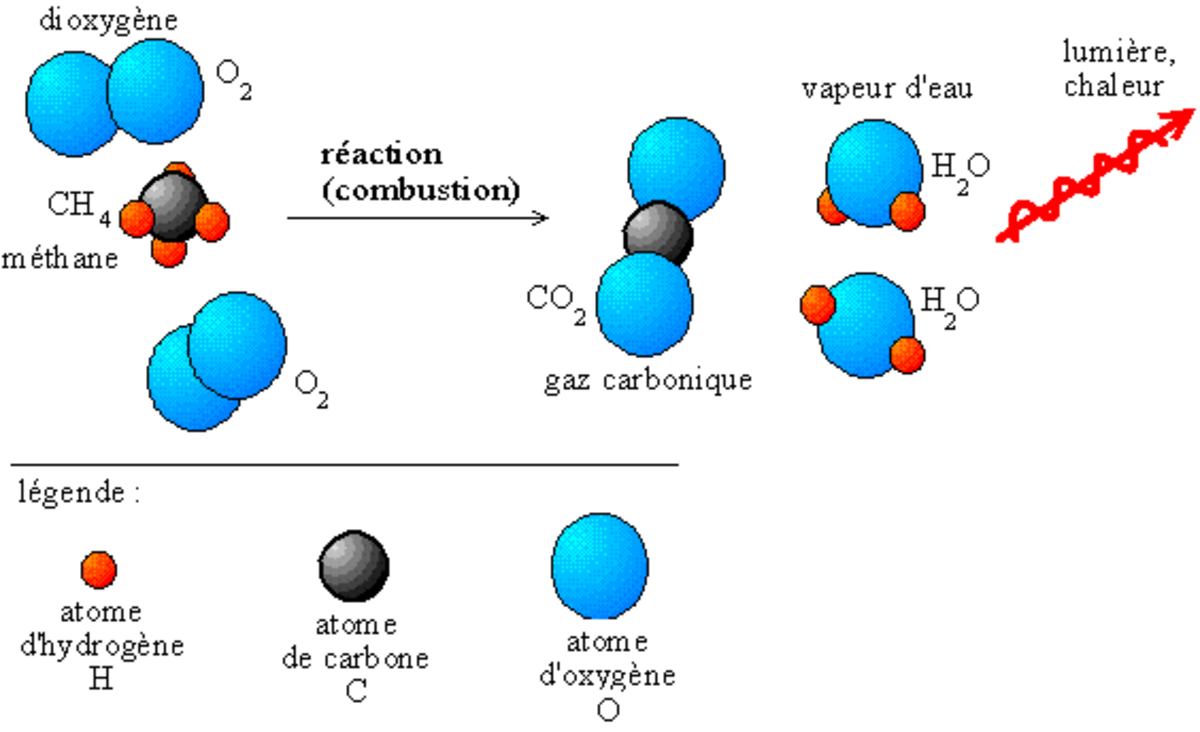
La réaction de combustion, comme toutes les réactions, est la rupture des liaisons entre les molécules de deux corps, et la création de nouvelles molécules plus stables chimiquement.
- Exemple : combustion du méthane dans le dioxygène
- Le dioxyde de carbone
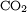 et l’eau
et l’eau 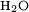 sont plus stables que le dioxygène et le méthane.
sont plus stables que le dioxygène et le méthane.
La combustion est une réaction d'oxydo-réduction, en l’occurrence l’oxydation d’un combustible par un comburant ;
- le combustible est le corps qui est oxydé durant la combustion ; c'est un réducteur, il perd des électrons ;
- le comburant est le corps qui est réduit ; c'est un oxydant, il gagne des électrons.
Certains composés chimiques, appelés catalyseurs, modifient par leur présence la quantité d’énergie nécessaire pour activer la réaction, soit en la réduisant (activateur), soit en l’augmentant (inhibiteur).
Dans le cas des combustibles solides, l’énergie d’activation va permettre de vaporiser ou de pyrolyser le combustible. Les gaz, ainsi produits, vont se mélanger au comburant et donner le mélange combustible. Si l’énergie produite par la combustion est supérieure ou égale à l’énergie d’activation nécessaire, la réaction de combustion s’auto-entretient.
Énergie dégagée et pouvoir calorifique
La quantité d’énergie produite par la combustion est exprimée en joules (J) ; il s'agit de l'enthalpie de réaction. Dans les domaines d'application (fours, brûleurs, moteurs à combustion interne, lutte contre incendie), on utilise souvent le notion de pouvoir calorifique, qui est l'enthalpie de réaction par unité de masse de combustible ou l'énergie obtenue par la combustion d'un kilogramme de combustible, exprimée en général en kilojoule par kilogramme (noté kJ/kg ou kJ·kg-1).
Les combustions d'hydrocarbures dégagent de l'eau sous forme de vapeur. Cette vapeur d'eau contient une grande quantité d'énergie. Ce paramètre est donc pris en compte de manière spécifique pour l'évaluation du pouvoir calorifique, et l'on définit :
- le pouvoir calorifique supérieur (PCS) : " Quantité d'énergie dégagée par la combustion complète d'une unité de combustible, la vapeur d'eau étant supposée condensée et la chaleur récupérée "[1].
- le pouvoir calorifique inférieur (PCI) : " Quantité de chaleur dégagée par la combustion complète d'une unité de combustible, la vapeur d'eau étant supposée non condensée et la chaleur non récupérée "[2].
La différence entre le PCI et le PCS est la chaleur latente de vaporisation de l’eau (Lv) multipliée par la quantité de vapeur produite (m), qui vaut à peu-près 2 250 kJ·kg-1 (cette dernière valeur dépend de la pression et de la température).
On a la relation ![]() .
.
Vitesse du front de flamme et explosion
La combustion est caractérisée par la vitesse du front de flamme :
- La déflagration : vitesse de quelques centaines de mètres par seconde
- La détonation : vitesse de l’ordre du kilomètre par seconde (supérieure à la vitesse du son)
Feux de métaux
L'oxydation des métaux est en général lente. La chaleur dégagée est donc forte et est lentement dissipée dans l'environnement ; c'est le domaine de la corrosion (par exemple la rouille du fer et de l'acier).
Cependant, dans certains cas, l'oxydation est violente et constitue donc une combustion. Il existe cinq cas notables :
- combustion dans l'air du magnésium : le magnésium brûle facilement, en émettant une lumière très vive et blanche ; il était utilisé auparavant pour les flashs photographiques ;
- combustion du sodium dans l'eau : ce n'est pas à proprement parler le sodium qui brûle ; le sodium réagit violemment avec l'eau et provoque un dégagement de dihydrogène, et avec la chaleur produite par la réaction, le dihydrogène s'enflamme dans l'air ;
- aluminothermie : le comburant est ici un oxyde métallique, il s'agit d'une réaction chimique entre deux solides ;
- combustion à haute température et forte concentration de dioxygène : lorsque le métal est chauffé très fort et que l'on envoie du dioxygène pur, la réaction est suffisamment rapide pour s'auto-entretenir ; ce phénomène est utilisé pour l'oxycoupage au chalumeau, la lance thermique, et c'est aussi l'accident du " coup de feu " qui peut survenir avec un détendeur d'une bouteille de dioxygène (par exemple oxygène médical ou bouteille de chalumeau) ;
- combustion d'un métal sous forme de poudre ou de mousse : la réaction chimique se fait au contact entre le métal et l'air, or dans le cas d'une mousse ou d'une poudre, cette surface de contact (la surface spécifique) est très grande, la réaction est donc rapide et la chaleur dégagée importante ; c'est un phénomène comparable au coup de poussière.
Application en astronautique
La combustion est utilisée dans le domaine de l’astronautique pour fournir l’énergie de propulsion des engins spatiaux. Les termes correspondants en anglais sont burning et combustion.
Selon le type de combustion employée dans un propulseur, on parle de :
- Combustion en cigarette (en anglais cigarette burning et end burning) qui est une combustion d'un bloc de poudre caractérisée par une surface plane de combustion progressant dans la direction longitudinale, vers l'avant ou vers l'arrière ;
- Combustion érosive (en anglais erosive burning) qui est une combustion d'un bloc de poudre dans le cas où l'écoulement des gaz de combustion provoque une érosion du bloc ;
- Combustion transversale extérieure (en anglais external burning) qui est une combustion d'un bloc de poudre caractérisée par une surface de combustion s'étendant longitudinalement et progressant de l'extérieur vers l'intérieur ;
- Combustion transversale intérieure (en anglais internal burning) qui est une combustion d'un bloc de poudre qui s'effectue de l'intérieur vers l'extérieur à partir d'un canal central.