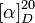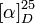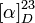Vitamine C - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Vitamine C | |
|---|---|
| |
| Général | |
| Synonymes | acide L-ascorbique |
| No CAS | |
| No EINECS | |
| Code ATC | A11 |
| No E | E300 |
| FEMA | |
| SMILES | |
| InChI | |
| Apparence | poudre ou cristaux blancs à légèrement jaune, inodore |
| Propriétés chimiques | |
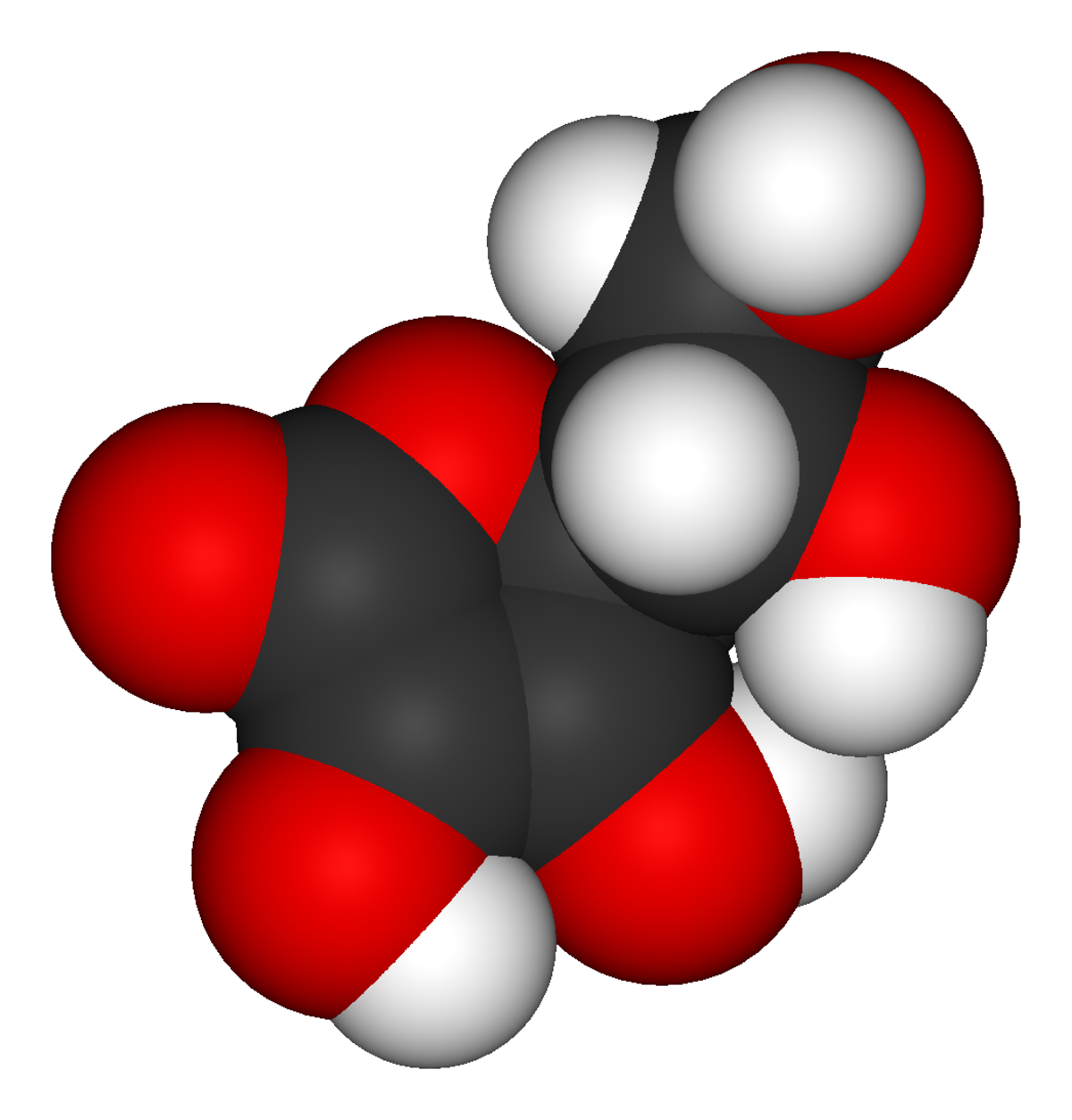
| Formule brute | C6H8O6 |
| Masse molaire | 176,1241 ± 0,0072 g·mol-1 |
| pKa | 4,70 (10 °C) |
| Propriétés physiques | |
| T° fusion | 190 à 192 °C (décomposition) |
| Solubilité | 0,33 g·ml-1 (eau); 0,033 g·ml-1 (éthanol 95%); |
| Masse volumique | 1,65 |
| Pression de vapeur saturante | 7,9179 Pa à 192 °C |
| Point critique | 509,85 °C 5,29×106 Pa |
| Propriétés optiques | |
| Indice de réfraction |
|
| Spectre d’absorption | absorption max : 245 nm (solution acide); |
| Pouvoir rotatoire |
|
| Précautions | |
| | |
| Phrases S : 24/25, | |
| Écotoxicologie | |
| LogP | -2,15 à 23 °C; -2,00 à 37 °C |
| | |
La vitamine C est une vitamine hydrosoluble sensible à la chaleur et à la lumière.
Chimiquement parlant, il s'agit de l'acide L-ascorbique et de ses sels, les ascorbates (les plus courants étant les ascorbates de sodium et de calcium).
Synthèse
Alors que la plupart des mammifères sont capables de la synthétiser dans leur foie ou dans leurs reins (ce n'est donc pas une vitamine pour eux), la majorité des primates (dont l'être humain), le cochon d'Inde et certains oiseaux et poissons en sont incapables. Ceci est le résultat d'une mutation génétique, survenue il y a 40 millions d'années, bloquant la transformation du glucose en acide ascorbique. Les animaux dépourvus de cette capacité de synthèse de la vitamine C doivent donc la puiser dans leur alimentation.
Action
La vitamine C est un cofacteur enzymatique impliqué dans un certain nombre de réactions physiologiques (hydroxylation). Elle est requise dans la synthèse du collagène et des globules rouges et contribue au système immunitaire. Elle joue également un rôle dans le métabolisme du fer en tant que promoteur de son absorption; son utilisation est donc déconseillée chez les patients porteurs d'une surcharge en fer et particulièrement d'une hémochromatose. Sous forme oxydée (acide déshydroascorbique), elle traverse la barrière hémato-encéphalique pour accéder au cerveau et à plusieurs organes à forte concentrations de vitamine C. Il s'agit d'un antioxydant, molécule capable de contrer l'action néfaste d'oxydants comme les radicaux libres. À cet effet, on emploie également la forme D- (Dextrogyre) de l'acide ascorbique qui, à l'inverse de la forme L- (Levogyre), ne présente pas d'activité vitaminique.
Conservation
Très fragile en solution, elle est détruite au contact de l'air (par oxydation) ou sous l'exposition à la lumière (par action des ultraviolets) et la chaleur accélère ces processus. Cependant, la chaleur seule ne détruit la vitamine qu'à l'approche de la température de fusion à 190 °C.